この項ではアルコール類の性質と代表的な反応を紹介します。
アルコール類の性質
まず、アルコールとはヒドロキシル基(-OH)を持つ化合物のことです(ただし、ベンゼン環にヒドロキシル基が付いたときはフェノールになるので、アルコールではありません)。
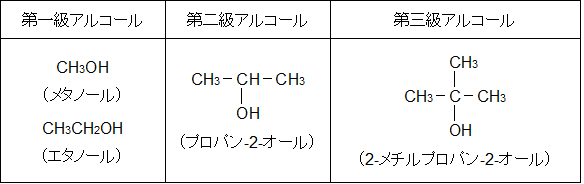
アルコールには、一価、二価、三価という呼び方や第一級、第二級、第三級という呼び方がありますが、ここはしっかり区別して覚えてください。
一価、二価、三価とは、化合物が持つ-OH 基の数で決まる呼び名です。-OH 基を 1 つ含む化合物なら一価アルコールであり、以下、2 つなら二価、3 つなら三価アルコールとなります。
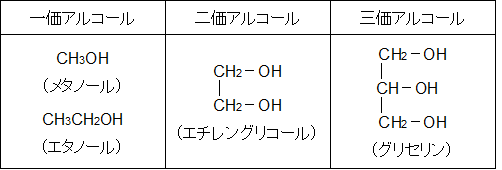
第一級、第二級、第三級という呼び方はハロアルカンなどと同様の考え方をします。
つまり、-OH 基に結合している炭素原子に別の炭素原子が 1 つ結合していれば第一級アルコールとなります。2 つ結合していれば第二級アルコール、 3 つ結合していれば第三級アルコールです。
また、アルコールは-OH 基という極性のある官能基を有するため水に溶けやすいのですが、水中で電離しにくいため、その液性は多くの場合、酸性でも塩基性でもなく、中性となります。
しかし、強塩基(NaH など)や金属ナトリウムと反応させると、R-OH が酸として働き、R-ONa という塩が生成します。
一方、-OH 基の O 原子が非共有電子対を有するため、ルイス塩基として働く場合もあります(ルイス塩基についてはルイス酸・ルイス塩基のページ参照)。
よって、アルコールは基本的には中性ですが、ある時は酸として、ある時は塩基として働きます。
アルコール類の反応(C-O 間の反応)
アルコール類は ROH で表すことができる通り、その構造に C-O-H という部分があります。アルコールの反応は大体このうち、C-O 間の結合が切れる反応か、O-H 間の結合が切れる反応かの2種類に大別することができます。
この項では前者の具体例を紹介し、後者については次項にて扱います。
C-O 間の結合が切れる反応で代表的なものといえば、アルコールの脱水反応によるアルケンの生成です。まず次の反応式を見てください。
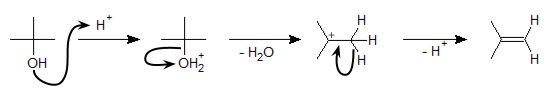
上図のように、この反応では最初にアルコールのヒドロキシル基がプロトン化されます。-OH だと脱離能(脱離しやすさ)が低いのですが、-+OH2 になると脱離能が上がるので、脱水反応が進行します。結果として、二重結合ができ、アルコールはアルケンとなります。
これは E1反応の一種です(E1反応については脱離反応のページ参照)。E1反応ということは中間体としてカルボカチオンが生成しますが、カチオンの安定性から、この脱水反応は
- 第三級アルコール > 第二級アルコール > 第一級アルコール
の順に起こりやすいといえます。
脱水反応と並んで重要な反応に、ハロアルカンの生成反応があります。アルコールにハロゲン化水素を作用させると、SN1反応が起こってハロアルカンが生成します(SN1反応は求核置換反応のページ参照)。
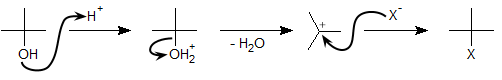
こちらも中間体としてカルボカチオンが生成するので、第三級アルコールでこの反応が起こりやすいといえます。

コメント