異性体とは、分子式がまったく同じであるのに構造は異なる分子のことを指します。例えば、エタノール(CH3CH2OH)とジメチルエーテル(CH3OCH3)はどちらも分子式がC2H6Oとなるため、これらは互いに異性体といえます。
また、異性体は構造異性体と立体異性体に分かれます。
構造異性体
構造異性体とは、分子式が同じというのは大前提として、炭素骨格が違ったり、置換基の位置が違ったり、官能基が異なっていたりと様々なタイプがあります。もちろん、これらの複合タイプもあります。構造異性体の例を以下に示します。
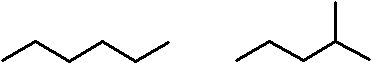
図1.どちらも C6H14 ですが、炭素骨格が異なります。
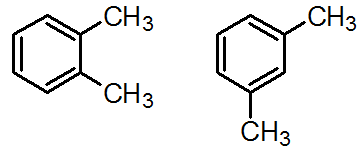
図2.どちらも C8H10 ですが、置換基(メチル基)の位置が違います。
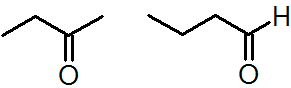
図3.どちらも C4H8O ですが、官能基が異なります(ケトンとアルデヒド)。
立体異性体
一方の立体異性体は、一見するとその分子構造(原子同士のつながり方)は互いに同じです。しかし、その空間配置が違うために異なる化合物という扱いとなり、違う性質(特に生物学的性質)を示すこともあります。
空間配置という表現では分かりづらいですが、立体異性体はよく右手・左手の関係と例えられます。右手も左手も親指の隣に人差し指があり、その隣には中指…と、互いに同じ構造をしていますが、どのように回転させても両手が重なり合うことはありません。
手のひらを合わせると表と裏(手のひらと甲)が反対になりますし、表裏を合わせると指の並びが反対になります。このような関係の化合物が立体異性体です。
具体例を以下に挙げます。
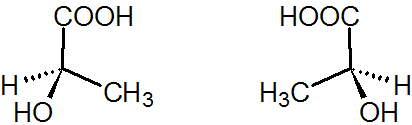
図4.R-乳酸(左)とS-乳酸(右)
上図の黒三角で示す結合は、紙面手前に飛び出ていることを表しています。また、破線三角で示す結合は、紙面の奥に伸びていることを表しています。
上図の両化合物は中心の炭素にH、CH3、OH、COOHが結合しているところまで共通していますが、どのように回転させても重なり合うことがありません。
よって、これらをそれぞれR-乳酸、S-乳酸と呼んで別の化合物として区別しています(D体・L体という呼び方もありますが、これらについては別の項で説明します)。
また、立体異性体はさらにエナンチオマーとジアステレオマーに分類できますが、それについても後の項で取り扱います。

コメント