化学反応には吸熱反応と発熱反応があります。基質(反応前の出発物質)よりも生成物のエネルギーのほうが高い場合、それは吸熱反応です。一方、基質よりも生成物のほうがエネルギーが低ければ、熱エネルギーを発散して生成物ができあがるので、発熱反応と呼びます。
ここまでの説明だと、吸熱反応は外からのエネルギーが必要で、発熱反応は勝手にどんどん反応が進む…というイメージを持つかもしれませんが、実際には違います。
吸熱反応・発熱反応というのはあくまで基質と生成物の持つエネルギー準位の比較であって、反応の起こりやすさはそれとは別の「活性化エネルギー」というもので決まります。以下の図を見てください。
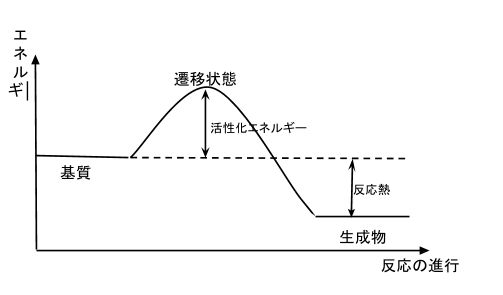
反応のエネルギー図
上図は発熱反応を示していますが、基質がエネルギーを発散してすぐに生成物に変化するわけではありません。図にある通り、基質は遷移状態である反応中間体を経て生成物となります。
そのため、たとえ発熱反応でも、まずは外からエネルギーを加えて遷移状態を越えなければ反応は起きません。よって、反応の起こりやすさというのは活性化エネルギーの大小で決まります。
活性化エネルギーが大きければ(図でいうと山の高さが高ければ)、それだけ反応は進みにくくなります。逆に活性化エネルギーが小さければ(山の高さが低ければ)、反応は進行しやすいということになります。
参考のため、以下に吸熱反応のエネルギー図も載せておきます。
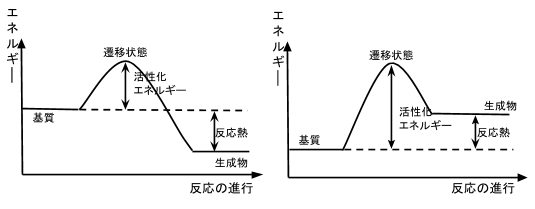
(左)発熱反応 (右)吸熱反応

コメント