問 題
ファントホッフの式に関する次の記述の ㋐、㋑に当てはまるものの組合せとして最も妥当なのはどれか。
「標準反応ギブズエネルギーを ΔG°、標準反応エンタルピーを ΔH°、気体定数を R、絶対温度を T、平衡定数を K、圧力を p とする。次の式 ①、②
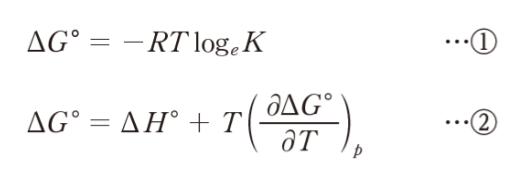
から導出される式 ③ は、ファントホッフの式と呼ばれ、平衡定数の温度変化を示す関係式である。
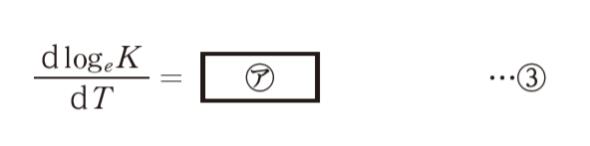
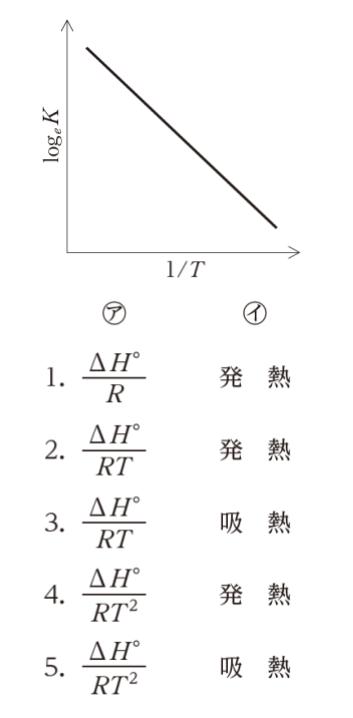
ΔH° が一定と考えられる程度に温度範囲が小さければ、ある ㋑ 反応について、logeK を1/T に対してプロットすると、図のような直線が得られる。この直線の傾きから ΔH° を求めることができる。」
正解.5
解 説
y = logeK とおきます。式 ③ の左辺は dy/dT と書き直すことができます。
図に注目すると、横軸が 1/T、縦軸を y とした時直線関係と読み取れます。従って、y = a × (1/T) + b という形です。両辺を T で微分すれば、右辺は 1/T2 が含まれます。従って、正解は 4 or 5 です。
㋑ ですが
発熱か吸熱かというのは、ΔH° が負か正かという問題です。dy/dT = ΔH°/RT2 なので、両辺積分すれば y = -(ΔH°/R)×(1/T) + b という形とわかります。図の直線の傾きは右下がりなので、明らかに負です。すると R は気体定数で正なので、ΔH° も正とわかります。ΔH° が正であれば、吸熱反応です。
以上より、正解は 5 です。

コメント