問 題
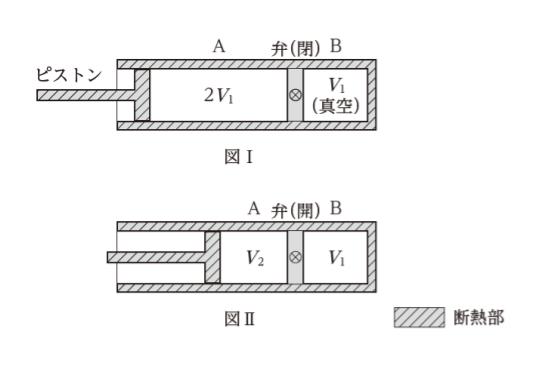
図Ⅰのように、断熱性の円筒形の容器が、熱をよく通す壁で二つの部屋 A(断熱性のピストンにより体積可変)及び部屋 B(体積 V1)に仕切られている。この壁には小さな弁があり、弁を開くと A、B 間で気体が少しずつ移動し、閉めると遮断されるようになっている。
初め、A の体積は 2V1 で、中に単原子分子の理想気体が入っており、A の圧力は外気圧に等しく、B は真空であった。この状態から、壁の弁を開いたところ、A の圧力は外気圧と等しい値を保ちながら、ピストンはゆっくりと移動し、図Ⅱのような熱力学的平衡状態となった。このときの A の体積 V2 として最も妥当なのはどれか。ただし、円筒容器、壁、ピストンの熱容量は無視できるものとする。
なお、物質量 n の単原子分子の理想気体の内部エネルギー U は、気体定数を R、絶対温度を Tとして、U = 3nRT/2 である。
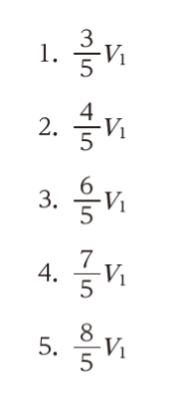
解 説
気体がされる仕事=内部エネルギーの増加 です。「気体がされる仕事」= 外力が行う仕事です。仕事 = 力 × 距離です。
「外力が行う」とは、本問において「ピストンが行う」です。ピストンがどれだけ移動したかを考えます。図Ⅰと図Ⅱを見比べて「3V1 ー (V1 + V2)」= 2V1 – V2 が、ピストンが移動した距離です。従って、外力がした仕事は P × (2V1 – V2) です。
pv = nRT より、U = 3pV/2 です。内部エネルギーの増加分は、ΔU = 3pΔV/2 となります。気体の体積変化ですが、元々 2V1 → V1 + V2 と変化しているため ΔU = 3p(V1 + V2) ー(2V1)/2 = 3p(V2 – V1)/2 です。
よって
P × (2V1 – V2) = 3p(V2 – V1)/2 です。
V2 について解けば
V2 = 7V1/5 となります。
以上より、正解は 4 です。

コメント