問 題
O2 分子に関する次の記述の ㋐、㋑、㋒ に当てはまるものの組合せとして最も妥当なのはどれか。
「電子基底状態における O2 分子の電子状態について考える。最高被占軌道は、縮重した ㋐ である。O2 分子は常磁性を示すが、これは縮重した軌道に関する ㋑ に従って電子配置を考えることで説明できる。
また O2 分子 O2+イオン及び O2ーイオンの結合距離をそれぞれ、RO2、RO2+、RO2- とすると、これらの間には ㋒ の関係が成り立つ。」

解 説
2p 軌道の 3 つ が重なり合って 6 つの軌道ができます。2px 同士、2py 同士によりできる結合性軌道と、反結合性軌道はエネルギー準位に違いがなく縮退するため、下図のような軌道になると考えられます。
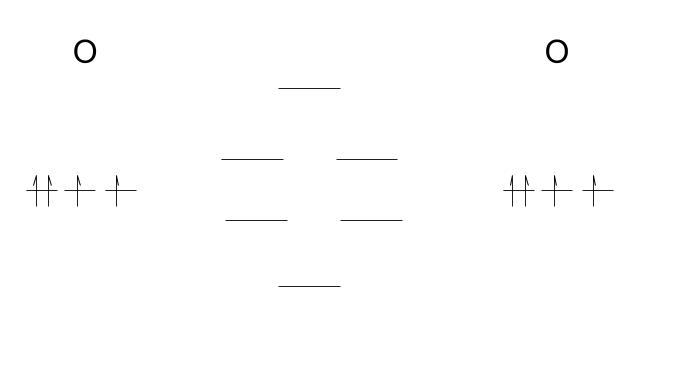
この 6 つの軌道のうち、下の3つが結合性、上の3つが反結合性です。電子は合わせて 8 個入るので、最高被占有軌道は、縮退した「反結合性軌道」です。常磁性を示すということはスピンが揃っているということです。これは「フントの規則」に基づき電子配置を考えると、同じスピンで縮退した軌道に1個ずつ電子が入るということから説明できます。
フントの規則とは「同じエネルギーの軌道が複数あるときは、電子は同じスピンのものがなるべく多くなるように複数の軌道に分かれて入る」という規則です。ここまでで ㋐ は反結合性軌道、㋑ がフントの規則です。正解は 4 or 5 です。
O2ーイオンは、反結合性軌道に電子がさらに一個入るため、結合が弱くなる方向であり、距離としては離れると考えられます。逆に O2+ イオンは、反結合性軌道の電子が一個減るため、結合が強くなる方向であり、距離としては近づくと考えられます。
以上より、正解は 4 です。

コメント