※2014年(平成26年)11月改正により
「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」、略称が「薬機法」となっています。適宜読み替えてください。
薬事法は、医薬品、医療機器等の、物に関わる法律です。薬事法の重要な項目として
・薬局の定義
・薬局開設者について
・薬局管理者について
・医薬品販売業について
・医療機器の販売について
・製造販売業について
・製造業について
・毒薬、劇薬、生物由来製品について の8つがあげられます。それぞれについて、詳しく解説します。
薬事法において「薬局」とは、医薬品の調剤及び販売業務を行う場所です。医療機関における調剤所は、薬事法上の薬局に入りません。
薬局の開設には、都道府県知事の許可が必要です。有効期間は6年です。管理者は、例外なく薬剤師です。管理薬剤師と呼ばれます。※開設者は、薬剤師である必要は、ありません。
薬局の開設者は、薬局選択を適切に行うための情報(薬局機能情報と呼ばれます。開局時間などについての情報のことです)を県知事に報告し、書面を閲覧できるようにする義務があります。(Web上の提供でもOKです)
薬局の管理者は、勤務する薬剤師その他の従業者を監督し、薬局の構造設備及び医薬品その他の物品を管理し、その他薬局業務につき、必要な注意をしなければなりません。又、薬局開設者に対し必要な意見を述べる必要があります。
医薬品販売業(薬局などのことです)の許可は、都道府県知事が行います。6年ごとに更新が必要です。
医療機器は、高度管理医療機器、管理医療機器、一般医療機器の3つに分類されます。
高度管理医療機器とは、人の生命及び健康に重大な影響を与える恐れがある医療機器として指定されているものです。コンタクトレンズなどが例としてあげられます。
管理医療機器とは、副作用又は機能の障害が生じた場合において、人の生命及び健康に影響を与えるおそれがある医療機器として指定されているものです。電子式の血圧計などが例としてあげられます。
一般医療機器とは、生命や健康に影響を与えるおそれがほとんどない医療機器のことです。絆創膏などが例としてあげられます。
医薬品製造販売業とは、医薬品を市場に供給する役割を、医薬品の製造、輸入、販売等を通じて実現する業務のことです。医薬品製造販売業者は、具体的には製薬会社のことです。
許可は、供給する医薬品の種類に応じて行われます。許可要件が3つあります。すなわち、人的要件、GQP(Good Quality Practice:製造販売品質保証基準)、GVP(Good Vigilance Practice:製造販売後安全管理基準)です。
人的要件とは、統括製造販売責任者(原則、薬剤師)などが配置されているかという要件です。
GQP、GVPは、製品の品質や安全性にの確保のためのルール作りや実際に行う作業内容に関する基準です。
医薬品製造業とは、医薬品の製造を行うことです。注意点として、製造業の許可だけでは、製品を市場に出荷できないという点が挙げられます。許可は、区分ごと、製造所ごとに行われます。
毒薬、劇薬、生物由来製品について、以下説明します。
毒薬とは、医薬品のうち、毒性が強い薬物のことです。代表例はウブレチドです。
劇薬とは、医薬品のうち、毒性が強い薬物のことです。毒薬よりは、毒性が低いものが劇薬として指定されます。代表例は、ニフェランタンCR、カロナール細粒です。
毒薬及び劇薬は、容器・被包が指定されています。下図のような表示が必要になります。

又、14歳未満や、安全な取り扱いに不安が認められるものには交付制限があります。更に、毒薬は、かぎをかけての保管が必要です。
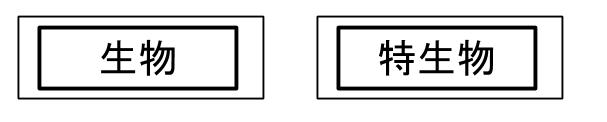
生物由来製品とは、ヒトその他の生物(植物は除く)に由来するものを原材料として製造される医薬品などのうち、特別の注意を要するものです。具体的には、ワクチンなどです。
又、生物由来製品のうち、販売・授与した後において、保健衛生上の危害の発生や拡大を防止するための措置を講ずることが必要なものであり、厚生労働大臣が薬事・食品衛生審議会の意見を聴いて指定するものを、特定生物由来製品と呼びます。
特定生物由来製品には、製造番号、記号に加え、ヒトの血液が原料の時は採血国名及び、採血方法(献血など)の記載が必要です。
生物由来製品及び特定生物由来製品の表示方法は、白地に黒枠黒字で、以下のような表示が必要です。

コメント