問 題
平衡状態にある次の化学反応系に関する記述のうち、正しいのはどれか。1つ選べ。
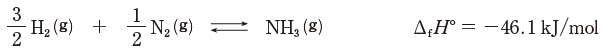
ΔfH°は標準生成エンタルピー、⒢は気体状態を表す。
- 系の温度を下げると、平衡は右側へ移動する。
- 系の圧力を下げると、平衡は右側へ移動する。
- 系に水素ガスを加えると、平衡は左側へ移動する。
- この反応は吸熱反応である。
- この反応の平衡定数は系の温度に依存しない。
解 説
標準生成エンタルピーとは、標準状態と呼ばれる圧力と温度で最も安定な状態の単体のもつエンタルピーを 0J と定め、標準状態で化合物 1mol が、その構成成分の単体から生成する時のエンタルピー変化のことです。(参考 物理化学 標準生成エンタルピー)
系が平衡状態にある時、微小な変化がおきると、系は平衡状態に戻ろうとします。(ルシャトリエ・ブラウンの原理と呼ばれます)。例えば、温度が少し低下すると、温度を上げようとします。つまり発熱反応がおきる方向に偏ります。
選択肢 1 は妥当です。
標準生成エンタルピーが負なので、アンモニアは発熱的化合物です。構成元素の単体からアンモニアが生成される本問の式は、発熱反応であるとわかります。従って、温度を下げる → 発熱し温度を上げようとする → アンモニア生成方向に偏ります。よって、平衡は右方向に移動します。
選択肢 2 ですが
系の圧力を下げると、ルシャトリエの原理から圧力を上げる方向に平衡が偏ります。与えられた反応式のどちらに進むと圧力が増すか というのは 左辺、右辺 それぞれの 係数の和 に注目して判断します。
本問の式では、左辺における係数の和が 3/2 + 1/2 = 2 です。一方、右辺における係数は1つしかなく、1です。化学反応が右に進行すると 圧力が下がる と判断します。言い換えれば、化学反応が左に進行すれば、圧力は上がるということです。従って、系の圧力を下げた時には、平衡は左側へと移動すると考えられます。選択肢 2 は誤りです。
選択肢 3 ですが
系に水素を加えると、平衡状態に戻ろうとする、つまり水素が減少する方向に平衡が偏ります。水素を消費する方向ともいえます。つまり、平衡は右側に移動すると考えられます。左側ではありません。選択肢 3 は誤りです。
選択肢 4 ですが
選択肢 1 の解説の通り 発熱反応と考えられます。選択肢 4 は誤りです。
選択肢 5 ですが
平衡定数ときたので ΔG = -RT lnK を思い出します。変形して、K = e-ΔG/RT です。明らかに温度に依存すると判断できるのではないでしょうか。(参考 106-98 熱力学パラメータの温度依存性)。選択肢 5 は誤りです。
以上より、正解は 1 です。

コメント