配位結合
配位結合とは、結合を成す2つの原子のうち、一方の非共有電子対と他方の空軌道との重なりで作る結合のことです。
その結果できあがる結合は共有結合となんら変わりはありませんが、結合を作る際の電子の数が1+1=2ではなく2+0=2というところが特徴です。
配位子
錯体の中心金属に配位結合する分子やイオンのことを「配位子」といいますが、金属結合に直接結合している原子のことは「ドナー原子」または「配位原子」と呼びます。
例えば配位子がNH3ならドナー原子はNということになります。ドナー原子の種類はC, N, O, P, S, Cl, …など、様々です。
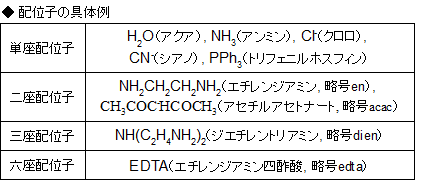
また、配位子は「単座配位子」と「多座配位子」に分けられます。
単座配位子とは、ドナー原子を1つしか持たない配位子のことです。H2OやNH3などがそれに当たります。
一方でNH2CH2CH2NH2という配位子はドナー原子(ここではN)を2つ持ち、このように複数個のドナー原子を持つ配位子を多座配位子といいます。より具体的には、二座配位子、三座配位子というような呼び方をします。

キレート試薬
多座配位子による金属イオンへの配位をキレートといいます。
キレート試薬とは、金属イオンを分離または定量する目的で用いられる多座配位子のことです。キレート試薬は金属イオンと結合すると呈色するものも多く、比色分析試薬として適しています。また、MRIの造影剤や重金属の排泄剤など、医薬品としても有用です。
代表的なキレート試薬には、前述のエチレンジアミンやエチレンジアミン四酢酸などがあります。
錯体の安定度数
配位子をL(リガンド)、金属イオンをM(メタル)とすると、金属錯体(ML)は以下のような平衡反応で表すことができます。この時の平衡定数kは錯体の安定度を表しているため、このkを安定度定数と呼ぶこともあります。
M + L ⇄ ML
k = [ML] / [M] [L]
キレート効果
キレート試薬については前述の通りですが、ひとことで表すと多座配位子のことです。
そしてキレート効果とは「多座配位子は単座配位子よりも安定な錯体を形成しますよ」といった多座配位子による安定性を指す言葉です。
錯体が安定するかどうかは、以下に示すいくつかの構造的な要因が合わさって決まります。
- キレート環の大きさ:クラウンエーテルなどは環状のキレートですが、その環の大きさによって適する中心金属が違ってきます。
- キレート環の数:これにより、配位子の数が変わってきます。
- 置換基の影響:配位子の置換基によって電子密度などが変化するため、錯体の安定性も置換基によって異なります。
錯体の反応性
錯体の反応の代表的なものに、配位子の交換反応が挙げられます。交換反応は、配位結合が切れて別の置換基との結合を成すような反応です。この交換反応の反応性を決める要因として、以下のようなものがあります。
- 金属イオンの酸化数:一般に酸化数が大きいほど配位結合のつながりが強くなります。
- 配位子の影響:前述のキレート効果によるものなどです。
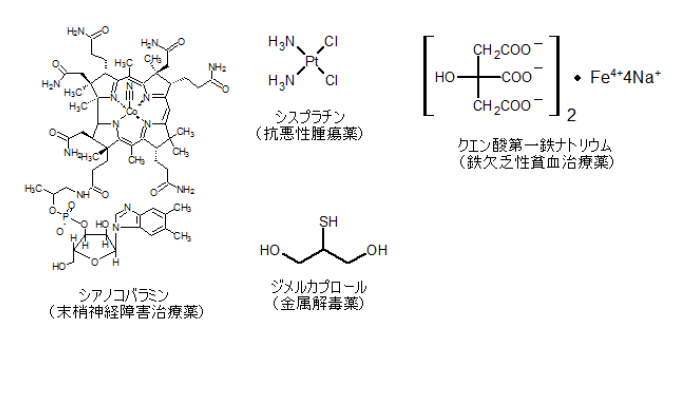
金属含有医薬品の例
無機化合物の単元の終わりに、金属元素(錯体)を使った医薬品の例をいくつか挙げておきます。

コメント