錯体
錯体とは、分子の中心にある元素に対し、それを取り囲むようにして非共有電子対をもつ配位子が結合したような化合物のことです。中心の元素が金属の場合、特に「金属錯体」と呼びます。
配位子はリガンドと呼ばれることもあり、非共有電子対を持つ分子やイオンです。例えば水分子(H2O)や塩素イオン(Cl–)が配位子に当たります。
ビタミンB12は以下のような構造であり、中心金属がコバルトの金属錯体です。
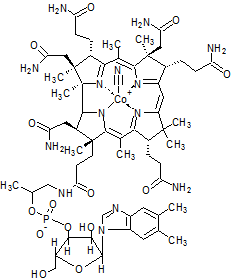
図1.ビタミンB12(シアノコバラミン)
また、赤血球の中にヘモグロビンというタンパク質が含まれていますが、これの構成要素であるヘムという分子はまさに金属錯体です。その中心金属は鉄です。葉緑体に含まれるクロロフィルもまた金属錯体で、その中心金属はマグネシウムです。
このように、錯体は生理学に重要なものも多く、医薬品にも広く使われています。また、錯体の中には有機反応において触媒として重宝されているものも数多くあります。
錯体の名称
- 錯体の化学式を書く際は、中心金属と配位子を[ ]で囲みます。[ ]内では最初に中心金属、次に陰イオン性配位子、その後に中性配位子を表記します。
- 対イオンを含めて書く場合は陽イオン、陰イオンの順番で書きます。対イオンを入れない場合は、[ ]の右肩にその電荷を記します。
- 配位子がH2Oのように多原子の場合は、(H2O)のように( )内に入れます。Cl–のような単原子だとそのまま書きます。
以上のことから、例えばテトラアンミン銅錯体であれば [Cu(NH3)4]2+ と表記することになります。
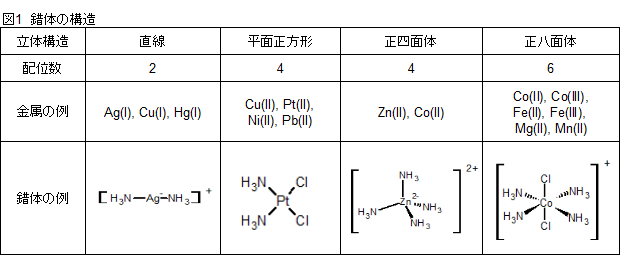
錯体の構造
錯体の構造は中心金属や配位子の種類によって様々な形態を取ります。以下の表を参照してください。

コメント