有機化合物の中には、そのルイス構造式を書こうとした時、複数の正しい構造式を書ける場合があります。例えば二酸化硫黄のルイス構造式を考えてみてください。
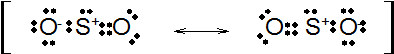
図1
8電子則を満たすため、二酸化硫黄は分子内で正電荷と負電荷を持つことになります。その際、図の左側のように左の酸素が負電荷を帯び右の酸素が二重結合を形成しても良いし、図の右側のように逆の配置でも良いはずです。
このように左右どちらの書き方でも正しい場合この2つのルイス構造式は互いに共鳴構造であるということになります。
共鳴構造を考える際に大事なことは全ての原子の位置は変えずに電子の位置が異なるということです。
また、共鳴構造を示す際に大事なことは、図1にもあるように互いの構造を両頭矢印で結ぶことと、全体をかっこで覆うことです。矢印を↔ではなく⇄にしてしまうと、こちらは平衡反応を示すことになりますので全く別の意味になってしまいます。注意してください。
ところで、分子というのは本来、電荷が局在化しているとエネルギー的に不安定であり、電荷が分子全体に分散しているほうが安定です。この電子の分散した状態を電子の非局在化といいますが、図1の左側の構造式も右側の構造式も、だいぶ電荷が偏っています。
そこで、大事な概念として、二酸化硫黄は図1の2つの構造式のどちらかの状態で居続けるというわけではなく、2つの構造の複合体となります。この複合体を共鳴混成体と呼びます。
共鳴混成体のイメージが沸きにくい場合は、2種の構造がものすごく早い速度で交互に入れ替わっているような状態を想像してください。その過程における電子の空間的な広がりが前述の「電子の非局在化」であり、その状態の分子全体が共鳴混成体です。
このように考えると、分子全体の電子の偏りはより小さくなります。つまり、図1の硫黄原子が+1の正電荷を帯びているのは変わりませんが、2つの酸素原子はそれぞれ-1/2の負電荷を帯びるという勘定になります。
(補足)
先ほど、2つの矢印「↔」と「⇄」は違うと説明しましたが、具体例を挙げると以下のようになります。
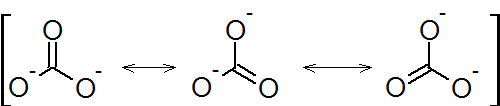
図2:炭酸イオンの共鳴構造式
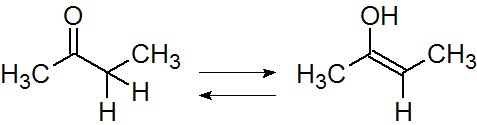
図3:平衡反応式(ケト-エノール互変異性)
図2の共鳴構造式と図3の平衡反応式を比べると、図2では全ての原子が動いていないのがわかります。つまり、電子のみが移動しています。
一方の図3ではもちろん電子は動きますが、水素原子も移動しています。このような場合は共鳴ではなく、平衡反応と呼ぶことになります。また、ケト-エノール互変異性については別の項で扱います。

コメント