有機化合物が反応する際には、その化合物内の結合(共有結合)が切れたり繋がったりします。結合が切れることを「開裂」、新たに結合ができあがることを「生成」といいます。
結合の開裂
ルイス構造の項で説明したように、共有結合は2つの電子から成ります。有機反応によってその結合が切れる時には、2つの電子がどうなるのかで開裂の仕方に違いがでます。その違いは以下の図の通りです。
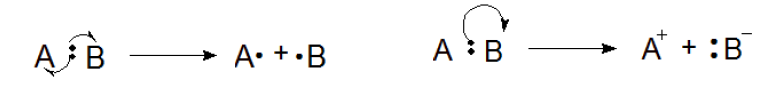
(左)図1.ホモリシス (右)図2.ヘテロリシス
図1に示すように、結合を成していた2つの電子がばらばらになり、反応後の2つの生成物のそれぞれに1つずつ付くような開裂の仕方を「ホモリシス」と呼びます。
「ホモ(homo-)」は「同じ」、「等価な」といった意味を持つ接頭語で、電子が生成物Aにも生成物Bにも等しく分配されることを指しています。
また、これら生成物A,Bのような不対電子をもった化合物を「ラジカル」といいます。このラジカルを使った反応(ラジカル反応)は重要なテーマですが、また別の項にて扱います。
一方、図2のように2つの電子が一方に偏って結合が切れるような開裂が「ヘテロリシス」です。
「ヘテロ(hetero-)」は「異なった」という意味の接頭語で、反応生成物がカチオン(陽イオン)とアニオン(陰イオン)に分かれることから、このような呼び方をします。
補足ですが、図1の片羽矢印は電子1つ分の移動を表します。図2の両羽矢印は電子2つ分の移動を表します。
ホモリシスとヘテロリシス、この違いは大事なので覚えておく必要があります。2つの電子が均一に開裂し、2つのラジカルを生成するのがホモリシスです。2つの電子が不均一に開裂し、カチオン(陽イオン)とアニオン(陰イオン)を生成するのがヘテロリシスです。
結合の生成
上記のホモリシス・ヘテロリシスの違いが分かれば、生成についても容易に理解が出来ます。開裂反応の逆を考えれば良いだけです。以下の図で確認してください。
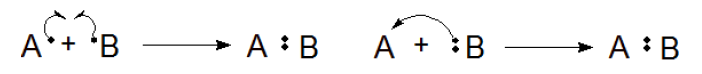
(左)図3.ラジカル反応 (右)図4.イオン反応(極性反応)
図3はホモリシスの逆で、ラジカル反応といいます。その名の通り、ラジカル同士が1つずつ電子を出し合って結合を生成します。
図4はヘテロリシスの逆で、イオン反応または極性反応です。アニオン(陰イオン)の持つ2つの電子(孤立電子対)をカチオン(陽イオン)に供与することで、結合を生成します。

コメント