化合物の構造式を書く際、前項までで見てきたように一般的には結合を線で示すことが多いです。一方、価電子を「・」で示すような構造式をLewis(ルイス)構造式と呼んでいます。
価電子の数は水素原子なら1つ、炭素原子だと4つ、酸素原子では6つ、と原子により様々ですが、分子の構造を見ると、基本的にはどの原子の周りにも8つの電子が配置されるような構造を取っています(水素原子の周りのみ、2電子で安定)。このことを8電子則といいます。
8電子則に従うと、分子がどのような構造を取っているのか(どのような結合をしているのか)を知ることが出来ます。
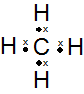
上の図がメタン(CH4)のルイス構造式です。炭素は価電子を4つ持っていて(●で表現)、水素は価電子をそれぞれ1つずつ持っています(×で表現)。
結果としてメタン分子の炭素の周りには8電子、水素の周りには2電子が存在することになるので、メタンは安定した分子となります。
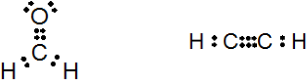
上の図(左)は、メタナール(慣用名:ホルムアルデヒド)のルイス構造式です。図のように炭素と酸素の間に2対(4つ)の電子を配置することで全ての原子が8電子則を満たします(水素は2電子)。ここでの2対の電子というのが、つまりは二重結合を意味します。
また、三重結合を持つエチン(慣用名:アセチレン)の場合、上の図(右)のようなルイス構造式が書けます。

コメント