界面とは、2つの相が接している時の、境界面です。例としては、水滴と空気の境界面が挙げられます。
液体の表面において働く力が表面張力です。表面の分子は、液体に触れていない部分が液体分子の影響を受けないため、内部へと分子間力により引きこまれます。この引き込まれる力の和が表面張力です。(分子間力が強いほど、表面張力も強くなります。)その結果、表面積が最小になるように、すなわち表面が球状になります。表面張力の単位は J/m2, 又は N/m です。(N/mは、J=N・mより導くことができます。)
分子間力は、溶液の溶質濃度と密接な関係があります。溶質の濃度と、表面張力の関係は、Gibbs(ギブズ)の吸着等温式で表されます。以下の式になります。

表面張力の測定法として代表的なものが2つあります。毛管上昇法と、滴重法です。実際の測定法としてはそれぞれ円環法(デュヌイのリング法)と、ウィルへルミーのつり板法が知られています。
表面張力が関与する、製剤において重要な概念がぬれです。ぬれとは、気体-固体の界面が、液体-固体の界面に置換する現象のことです。要は、今まで液体が触れていなかった部分が、液体で濡れるという現象です。ぬれを考慮することは、粉末医薬品の品質や、動態において重要です。ぬれは、接触角により分類されます。接触角とは、下図の θ のことです。
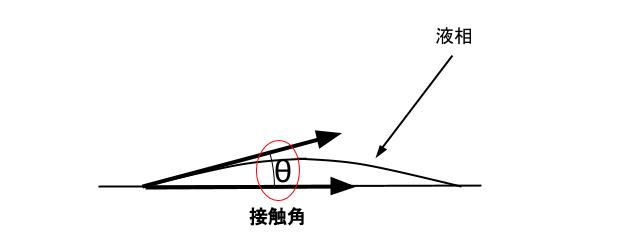
接触角θ=0、つまりぺた~っと液相が広がるようなぬれのことを、拡張ぬれと呼びます。接触角が θ = 0 ~ 90、つまりじわ~っと液相が広がるようなぬれのことを浸漬ぬれと呼びます。接触角が θ = 90 より大きい、つまり ぴとっと 液相がつくようなぬれのことを付着ぬれと呼びます。
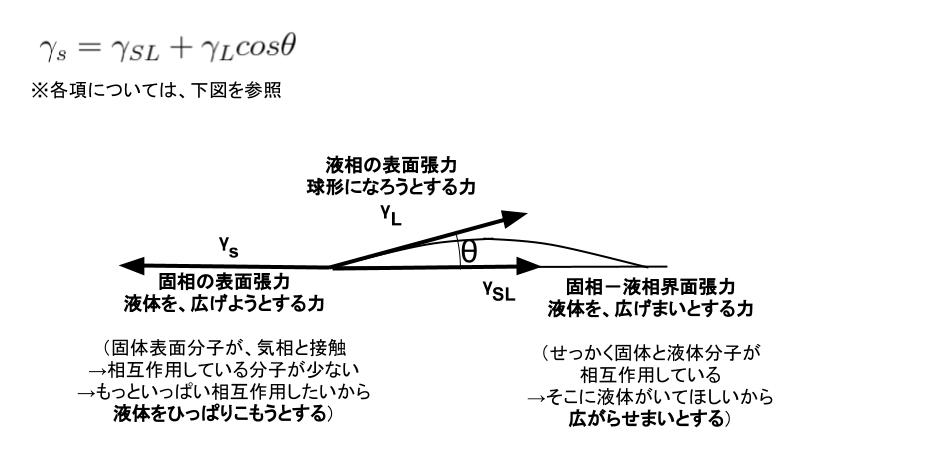
ぬれにおける表面張力の関係として、Young(ヤング)式が知られています。以下の式になります。

コメント