固体薬物の多くは、弱電解質です。このため、溶解に酸・塩基反応が関与します。具体的には、酸性物質の場合、溶液のpHが上がると、イオン形濃度が増加し、分子形比率は下がります。言い換えると、酸性物質は、塩基性溶液の中で溶けやすいということです。
又、塩基性物質の場合、溶液の pH が下がると、イオン形濃度が増加し、分子形比率は下がります。言い換えると、塩基性物質は、酸性溶液の中で溶けやすいということです。
pHと、pKa、及び分子形、イオン形の濃度の関係を表した式が、Henderson-Hasselbalch(ヘンダーソン・ハッセルバルヒ)の式です。以下のような式になります。
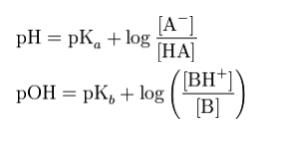
この式から、丁度薬物が溶けている溶液の pH が、ある温度、溶媒における薬物の pKa と等しい時、分子形とイオン形の比率が1:1になることがわかります。

コメント