問 題
酸・塩基に関する次の記述の ㋐、㋑ に当てはまるものの組合せとして最も妥当なのはどれか。ただし、アンモニアの塩基解離定数 Kb について、pKb = 4.8、水のイオン積は Kw = 1.0 × 10-14 mol2・L-2 とする。
「0.10 mol・L-1 のアンモニア水の pH は、約 ㋐ である。また、0.10 mol・L-1 のアンモニア水 1.0 L に、0.50 mol・L-1 の塩酸を 100 mL 加えたときの pH は、約 ㋑ である。」
解 説
【弱酸、弱塩基の pH】
弱酸 HA の電離による pH
弱塩基 B の電離による pH
弱酸と強塩基から生じた塩のpH
強酸と弱塩基から生じた塩の pH
の 4 パターンについては、公式を覚えて対応するのがよいと思われます。
・弱酸 HA の電離による pH
→[H+]=√(Ka・C)
・弱塩基 B の電離による pH
→[OHー]=√(Kb・C)なので
[H+]=Kw/√(Kb・C)
・弱酸と強塩基から生じた塩のpH
→ 弱塩基による電離と同じ。
・強酸と弱塩基から生じた塩のpH
→ 弱酸による電離と同じ。 となります。
※ 大前提となるのは Ka・Kb = Kw です。
Kw とは、水のイオン積のことです。また、pH のように小文字の p を付けるのは「ーlog10」という意味です。
ーーーーーー
㋐ ですが
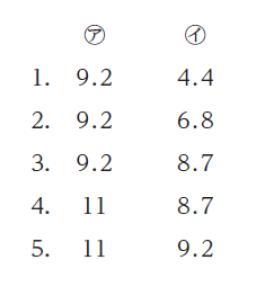
本問は「弱塩基 B の電離による pH」のパターンです。pKb が与えられているので、[OH–] の公式の両辺に -log10 をとります。計算すると、pOH = 2.9 とわかります。pH + pOH = 14 なので、pH ≒ 11 です。正解は 4 or 5 です。

㋑ ですが
こちらは弱塩基 + その塩という組み合わせになるので、緩衝溶液ができます。緩衝溶液、pH と来たら Henderson-Hasselbalch (ヘンダーソン-ハッセルバルヒ)の式です。pH = pKa + log[分子形]/[イオン形] が成立します。
塩酸との中和反応により、[NH3] が、0.1 mol/L × 1L ー 0.50 mol/L × 0.1L = 0.05 mol です。そして、[NH4Cl] が同量の 0.05 mol になります。
つまり
ヘンダーソンハッセルバルヒ式における「分子形」と「イオン形」が同じ値となります。そのため、pKa がそのまま pH となります。pKa = 14 – pKb なので、14 – 4.8 = 9.2 が求める pH です。
以上より、正解は 5 です。

コメント