問 題
0.80 mol・L-1 のアンモニア水の pH はおよそいくらか。
ただし、log102 =0.30、log103 = 0.48、アンモニアの電離定数は 1.8 × 10-5 mol・L-1 、水
のイオン積は 1.0 × 10-14 mol2・L-2 とし、アンモニアの電離度は 1 に比べて十分に小さいとする。
1. 10.6
2. 11.1
3. 11.6
4. 12.1
5. 12.6
正解.3
解 説
弱酸 HA の電離による pH、弱塩基 B の電離による pH、弱酸と強塩基から生じた塩のpH、強酸と弱塩基から生じた塩の pHの 4 パターンについては、公式を覚えて対応するのがよいと思われます。
・弱酸 HA の電離による pH→[H+]=√(Ka・C)
・弱塩基 B の電離による pH→[OHー]=√(Kb・C)なので、[H+]=Kw/√(Kb・C)
・弱酸と強塩基から生じた塩のpH→ 弱塩基による電離と同じ。
・強酸と弱塩基から生じた塩のpH→ 弱酸による電離と同じ。 となります。
※ 大前提となるのは Ka・Kb = Kw です。Kw とは、水のイオン積のことです。また、pH のように小文字の p を付けるのは「ーlog10」という意味です。
本問は「弱塩基 B の電離による pH」のパターンです。
公式に値を代入し、両辺 -log10 をとって計算します。以下のように計算をすすめると
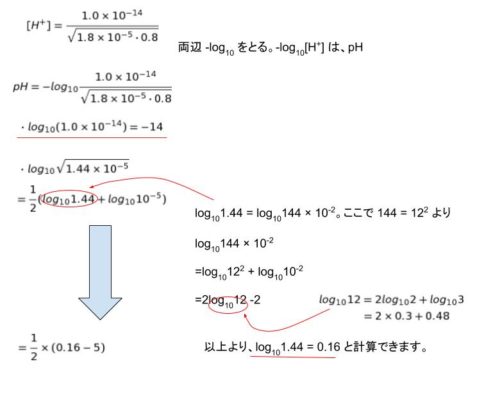
pH = -(-14 -(-2.42))
=14 – 2.42 ≒ 11.6 です。
以上より、正解は 3 です。

コメント