酸・塩基平衡を維持するために大きな役割を果たしているのが緩衝作用です。緩衝作用とは、水溶液の pH をある一定の範囲に保つ作用であり、一般に「弱酸とその塩」、もしくは「弱塩基とその塩」の混合溶液において強い緩衝作用を持ちます。
イメージとしては、弱酸や弱塩基がその溶液の pH を決定するとともに、塩が外部からの H+ や OH– を撃退してくれるイメージです。さらに具体例を用いて説明します。
弱酸として CH3COOH (酢酸),その塩として CH3COONa (酢酸ナトリウム)があるとします。水溶液中で、酢酸はわずかに電離することで、H+ がある程度の量溶液中に存在します。
塩である酢酸ナトリウムは、完全に電離し、溶液中で CH3COO– と Na+ として多量に存在します。
すると、例えば外部から H+ が入ってくると、たちまち CH3COO– と結合して CH3COOH となります。系中の CH3COOH は増えますが、弱酸であるため、H+ はそれほど増えません。又、外部から OH– が入ってくると、これは酸塩基反応がおきて CH3COOH と反応することで OH– は
系中から除去されます。これにより、系中の CH3COOH は多少減りますが、やはりそれほど H+ の量は変わりません。
緩衝液の pH は、Henderson-Hasselbalch (ヘンダーソン-ハッセルバルヒ)の式により算出することができます。すなわち、下の式のようになります。
pH = pKa + log [イオン形]/[分子形] (酸性緩衝液の場合)
pOH = pKb + log [イオン形]/[分子形] (塩基性緩衝液)
(pH = pKa + log [分子形]/[イオン形] (塩基性緩衝液の場合))
※ Ka は、共役酸の Ka)
※ pH と pKa が等しい時が、イオン形と分子形が丁度1:1で存在する時となります。
補足 塩基性緩衝液について
2つの表現方法について、どのようにして導かれるかを、以下に示します。
B を塩基として
B + H+ ⇄ BH+
なので、左右をひっくり返して
BH+ ⇄ B+ + H+
この時の Ka は
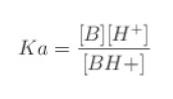
です。両辺 対数をとると
log Ka = log[H+] + log [分子形]/[イオン形]
両辺に -1をかけると
-log Ka = -log[H+] -log [分子形]/[イオン形]
より
pKa + log [分子形]/[イオン形] = pH
左右をひっくり返して
pH = pKa + log [分子形]/[イオン形]
です。
この式に対して
pH + pOH = 14 及び、pKa + pKb = 14 を代入すると
pOH = pKb + log [イオン形]/[分子形]
となります。

コメント