緩衝液とは、外部から酸や塩基が加えられた時、pH 変化への影響を和らげようとする作用を有する溶液のことです。イメージとしては、緩衝液とは塩酸や水酸化ナトリウムを入れても、なかなかpHが変化しない溶液です。
一般に、緩衝液は、弱酸+その酸の塩 (例:酢酸と、酢酸ナトリウム) もしくは、弱塩基とその塩 (例:アンモニアと、塩化アンモニウム)の混合溶液で、この作用が強くなります。
なぜこのような組み合わせで緩衝作用を有するのか、具体例を通じて説明します。酢酸と、酢酸ナトリウムの混合溶液に対して外から酸(H+)、塩基(OH–)が加えられた時についてまとめたのが、下の式及び解説です。
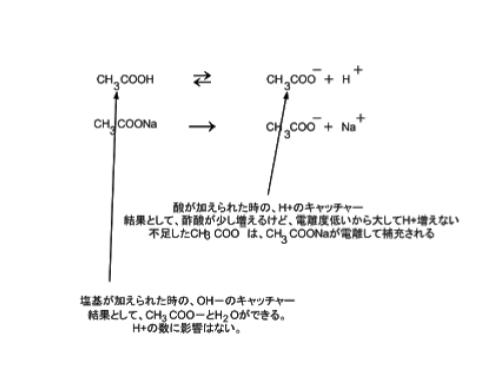
緩衝液は、一般に弱酸(もしくは弱塩基)の pKa ± 1.0 程度の pH でよく緩衝能を示します。
先ほどの例にあげた、酢酸と、酢酸ナトリウムの混合溶液では、酢酸の pKa =4.7 であり、混合溶液は pH 4.0 ~ 5.0 付近でよい緩衝能を示します。また、緩衝液の無機成分が影響を与えてしまう生物系の実験においては、有機物質を用いた緩衝液が用いられることもよくあります。例えばグリシン緩衝液や、トリス緩衝液です。

コメント