問 題
ある二次反応の速度定数 k を測定したところ、600 K では、0.500 mol-1・L・s-1、624 K では、1.36 mol-1・L・s-1 であった。この反応の活性化エネルギーはおよそいくらか。ただし、自然対数の底 e を 2.72、気体定数 R を 8.31 J・mol-1・K-1 とし、また、k は次のアレニウス式に従うものとする。
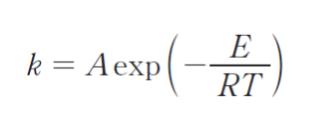
ここで,A は頻度因子、E は活性化エネルギー、T は絶対温度である。
1. 60 kJ・mol-1
2. 130 kJ・mol-1
3. 200 kJ・mol-1
4. 270 kJ・mol-1
5. 340 kJ・mol-1
解 説
600K の時 0.5、624K の時 1.36 なので
0.5 = Ae(-E/600R)
1.36 = Ae(-E/624R) となります。
上の式を A について解くと A = 0.5/e(-E/600R) です。これを下に代入します。
1.36 = 0.5/e(-E/600R) × e(-E/624R)です。
0.5 が邪魔なので 両辺 2 倍し、掛け算の形になおす(分母・分子に e(E/600R)をかける)と
2.72 = e(-E/624R) × e(E/600R) です。左辺が ちょうど e1 であることに注目します。
右辺の指数部分のみを見れば (E/R) × (1/600ー1/624) となります。これがちょうど 1 となればよいというわけです。
1/600 ー 1/624
= 1/(6 × 4 × 25) ー1/(6 × 4 × 26) なので、通分して計算すれば
1/(6 × 4 × 25 × 26) となります。R を 8.3 とみなせば、 (E/R) × (1/600ー1/624) の分母部分は大体 156 × 8.3 × 100 ≒ 130 × 103 です。全体で 1 なので、E ≒ 130 × 103 とわかります。
以上より、正解は 2 です。

コメント