問 題
次の記述 ㋐ 〜 ㋔ のうち Fe3+ を十分多量に含む水溶液にスズの板を入れたときの変化の説明として妥当なもののみを全て挙げているのはどれか。ただし,各イオンの水溶液中における標準電極電位 E° は次のとおりとする。
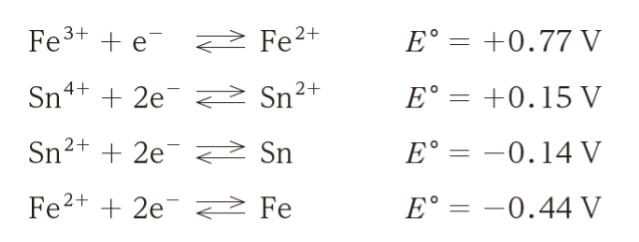
㋐ Fe3+ は還元され Fe2+ を生じる。生じた Fe2+ は更に還元され Fe を生じる。
㋑ Fe3+ は還元され Fe2+ を生じるが,生じた Fe2+ は Fe まで還元されない。
㋒ Sn は酸化され Sn2+ を生じる。生じた Sn2+ は更に酸化され Sn4+ を生じる。
㋓ Sn は酸化され Sn2+ を生じるが,生じた Sn2+ は Sn4+ まで酸化されない。
㋔ 変化は生じない。
1.㋐,㋒
2.㋐,㋓
3.㋑,㋒
4.㋑,㋓
5.㋔
正解.3
解 説
ΔG = -nFE を思い出します。
系中に Fe3+ が豊富で、入れたのがスズの板なので Sn です。Fe3+、Sn に関する半反応式(式の一番上と、下から二番目)に注目すれば 2Fe3+ + Sn ⇆ 2Fe2+ + Sn2+ で、電位が 2 × 0.77 – 0.14 = +1.40 です。E が正なので、ΔG は負です。ΔG が負なので、自然に進行します。
Fe3+ 豊富なので、次に Fe3+ と Sn2+ に注目すれば、同様に考えて、ΔG 負です。これも自然に進行します。
Fe2+ と Sn4+ や Fe2+ と Sn2+ では、E が負なので、ΔG が正です。ΔG が正なので、自発的進行は見られません。
従って、Fe3+ は Fe2+ まで還元され、Sn は Sn4+ まで酸化されるとわかります。
以上より、正解は 3 です。

コメント