問 題
イオン結晶 MX の陽イオン M+ の半径を r+ 、陰イオン X– の半径を r–(r– > r+ )とするとき、半径比 r+/r– は、MX がどのような構造をとるかを推測するのに有効である。
MX 型イオン結晶には、㋐、㋑、㋒ の代表的な構造がある。MX 型イオン化合物Ⅰ、Ⅱ、Ⅲのr+/r– がそれぞれ、0.3、0.6、0.9 であるとすると、これらの化合物に予想される結晶構造の組合せとして最も妥当なのはどれか。ただし、図中の ● は M+、○ は X– の位置を表し、実線は最近接イオンどうしを結んだものである。
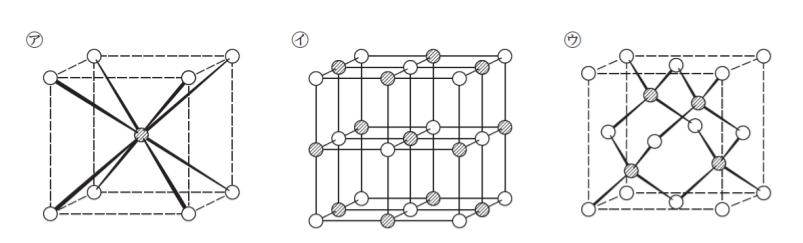
Ⅰ Ⅱ Ⅲ
1.㋐ ㋑ ㋒
2.㋐ ㋒ ㋑
3.㋑ ㋐ ㋒
4.㋒ ㋐ ㋑
5.㋒ ㋑ ㋐
正解.5
解 説
㋐ は塩化セシウム型、㋑ は塩化ナトリウム型、㋒ は硫化亜鉛型 です。これは基礎知識です。
陽イオンに注目すると セシウムがやけに大きいと名前からわかるのではないでしょうか。すると半径比は ㋐ が一番大きいとわかります。
以上より、正解は 5 です。
ちなみに、結晶形と、イオン半径比の関係についてまとめると
・塩化ナトリウム(NaCl)型構造 0.41〜0.73
・塩化セシウム(CsCl)型構造 ≧0.73
・硫化亜鉛(ZnS)型構造 ≦ 0.41 です。

コメント