問 題
Fe3+ イオンに関する次の記述の㋐~㋓に当てはまるものの組合せとして最も妥当なのはどれか。ただし、[Ar] はアルゴンの電子配置を意味し、鉄の原子番号は 26 である。また有効ボーア磁子数 p は、全スピン量子数を S とすると、p = 2√S(S+1) で表される。
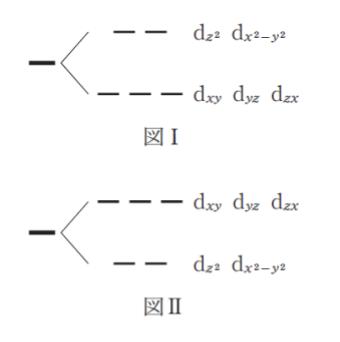
「八面体の結晶場に存在する Fe3+ では、縮重していた d 軌道のエネルギー準位は ㋐ のように分裂する。Fe3+ の電子配置は ㋑ であり高スピン状態での全スピン量子数は ㋒ である。また低スピン状態の有効ボーア磁子数は ㋓ である。」
㋐ ㋑ ㋒ ㋓
1. 図Ⅰ [Ar]3d34s2 3 2√2
2. 図Ⅰ [Ar]3d5 5/2 √3
3. 図Ⅰ [Ar]3d5 5 0
4. 図Ⅱ [Ar]3d34s2 3/2 √3
5. 図Ⅱ [Ar]3d5 5 2√2
解 説
5つの d 軌道は、2つの eg 軌道 と 3つの t2g 軌道 に分裂します。eg 軌道とは dx2-y2, dz2 です。t2g 軌道とは dxy, dyz, dxz です。上から eg、t2g の順です。これは基礎知識です。従って、分裂は図Ⅰが妥当です。正解は 1~3 です。
Fe3+ の電子数は 23 個です。[Ar] で 18 個電子を使っているため、残り 5 個です。高スピン状態では、5 つの軌道に 1 つずつ、同じスピンの電子が入ります。1 個につきスピン量子数は 1/2 なので、全スピン量子数は 5/2 です。低スピン状態においては、4個の電子が上下逆向きで 2 つの軌道に入り、1個だけ余る形なので、スピン量子数が 1/2 です。有効ボーア磁子数を計算すれば p = 2 × √(1/2 × 3/2) = √3 です。
以上より、正解は 2 です。
類題 H26 no28
https://yaku-tik.com/yakugaku/km-26-28/

コメント