問 題
H2 と CO2 を密閉容器に入れると、反応 ① が起こって平衡に達する。
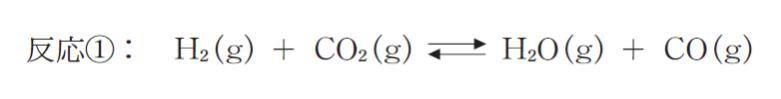
0.10mol の H2 と 0.20mol の CO2 を容器に入れ、450°C、5.0 × 104 Pa に保って平衡状態としたところ、混合気体の H2O のモル分率が 0.1 であった。温度、圧力を保ったままこの平衡系に適当な量の固体の CoO と Co を入れたところ反応 ② 及び反応 ③ が起こって新たな平衡に達した。
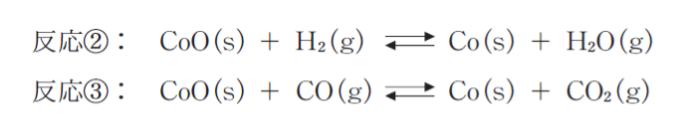
新たな平衡における混合気体の H2O のモル分率が 0.3 であったとすると、反応 ③ の圧平衡定数として最も妥当なのはどれか。
1. 63
2. 1.2× 102
3. 5.4× 102
4. 1.1× 103
5. 2.4× 104
解 説
反応 ① 開始時と、平衡時の物質量について、反応率を α とおくと、以下のようにまとめることができます。
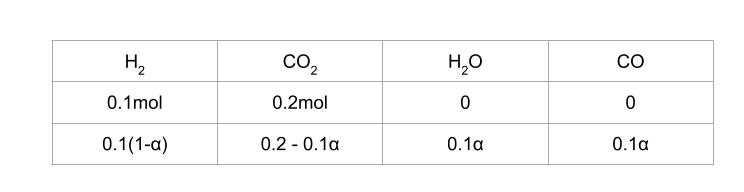
全体の mol 数は変わらず 0.3 mol です。H2O のモル分率が 0.1 ということなので 0.1α / 0.3 = 0.1 です。従って、α = 0.3 とわかります。従って、平衡時の H2、CO2、H2O、CO の物質量がそれぞれ 0.07、0.17、0.03、0.03 とわかりました。圧平衡定数は [H2O][CO]/[H2][CO2] = 0.03 × 0.03/0.07 × 0.17 = 9/119 です。
次に、反応 ② 及び ③ 開始時と、平衡時の物質量について考えます。反応 ② により減少する H2 の物質量を x、反応 ③ により減少する CO の物質量を y とおきます。以下のようにまとめることができます。
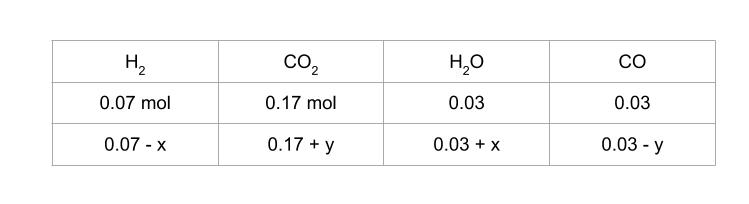
全体の mol 数は変わらず 0.3 mol です。H2O のモル分率が 0.3 ということなので (0.03 + x) / 0.3 = 0.3 です。従って、x = 0.06 とわかります。
反応 ③ の圧平衡定数ですが、気体は CO と CO2 なので、[CO2]/[CO] を考えればよいです。ここで、温度、圧力を保っているため、圧平衡定数は変化していないと考えられます。つまり圧平衡定数は [H2O][CO]/[H2][CO2] = 0.09 × (0.03 – y)/0.01 × (0.17 + y) = 9/119 となります。
119 ≒ 120 と近似すれば、 [H2O]/[H2] = 0.09/0.01 = 9 であることから [CO]/[CO2] が 1/120 とわかります。つまり、[CO2]/[CO] は 120 です。
以上より、正解は 2 です。

コメント