問 題
大気圧下において、物質 A は、融点及び融点における融解熱がそれぞれ 250K 及び 2.5kJ・mol-1 であり、沸点及び沸点における蒸発熱がそれぞれ 350 K 及び 30 kJ・mol-1 である。また、物質 A が液体のとき、すなわち 250K から 350K の温度範囲において、定圧モル比熱は 0.13kJ・K-1 mol-1 で一定と考えてよいものとする。
大気圧下、250K で全て固体になっている 1mol の物質 A を加熱し、全て 350K の気体にした。このとき融解に伴うエントロピー変化を ΔS1、液体の温度上昇に伴うエントロピー変化をΔS2、気化に伴うエントロピー変化を ΔS3 とするとき、それらの大小関係を表したものとして最も妥当なのはどれか。ただしlog e 250= 5.521、log e 350= 5.858とする。
1. ΔS1 < ΔS2 < ΔS3
2. ΔS1 < ΔS3 < ΔS2
3. ΔS2 < ΔS1 < ΔS3
4. ΔS2 < ΔS3 < ΔS1
5. ΔS3 < ΔS1 < ΔS2
解 説
等温において ΔS = Δq/T です。
定圧において ΔS = Cp lnT2/T1 です。Cp が、定圧モル比熱です。
本問における物質 A の状態変化と、過程における熱量をまとめると、以下のようになります。(S)、(L)、(G)はそれぞれ固体、液体、気体です。
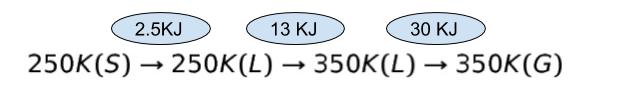
ΔS1 は、2.5kJ/250
ΔS2 は、0.13 × ln(350/250) = 0.13 × (5.858 – 5.521)
ΔS3 は、30/350 です。
それぞれ計算して比較すると
ΔS1 < ΔS2< ΔS3 です。
以上より、正解は 1 です。

コメント