問 題
0.10 mol/L の酢酸水溶液 50 mL に、0.50 mol/L の水酸化ナトリウム水溶液を加えた後、水を加えて全体を 100 mL とし 25°C で pH が 5.0 の水溶液に調整したい。加えるべき水酸化ナトリウム水溶液の量に関する次の記述の ㋐、㋑、㋒ に当てはまるものの組合せとして最も妥当
なのはどれか。ただし 25°C の酢酸の電離定数を 1.8 × 10-5 mol/L とする。
「pH 調整後の水溶液中の酢酸と酢酸イオンの濃度比は、[CH3COOH]:[CH3COO–] = ㋐ である。また陰イオンと陽イオンのバランスを考えると、H+ の濃度 OH– の濃度は、ナトリウムイオンの濃度、酢酸イオンの濃度に比べて十分小さいことから、[Na+] = [CH3COO–] = ㋑ mol/L と考えてよい。水酸化ナトリウムは完全に電離するので、ナトリウムイオン濃度が ㋑ mol/L となるように、0.50 mol/L の水酸化ナトリウム水溶液を ㋒ mL 加える。」
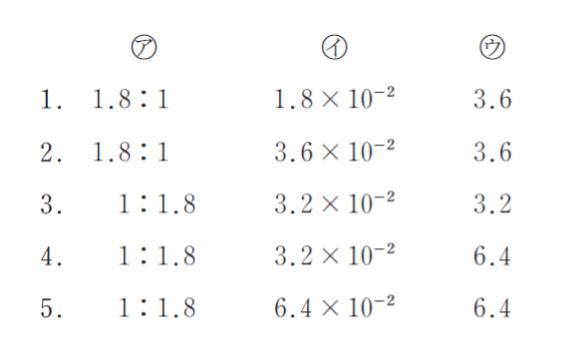
解 説
pH 調整後なので、pH = 5 です。これより[H+] = 10-5 mol/L とわかります。また、酢酸の電離定数を Ka とおけば、Ka = [CH3COO–][H+]/[CH3COOH] です。25 ℃において、Ka = 1.8 × 10-5 mol/L と与えられています。数値を代入すると、以下のようになります。
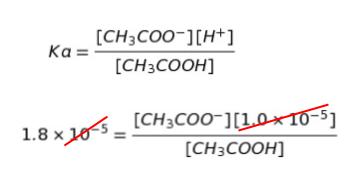
従って、㋐ は 1 :1.8 です。正解は 3 ~ 5 です。
初めに酢酸が 0.10 mol/L で 50mL あったのだから、CH3COOH が 0.005 mol あったとわかります。pH 調整後は ㋐ より、CH3COOH : CH3COO– が 1 : 1.8 とわかりました。これらは合わせれば 元の 0.005 mol のはずです。従って、CH3COO– の物質量は 0.005 × 1.8/2.8 です。それが 100 mL 中にあるので、求める濃度は以下の様に表すことができます。
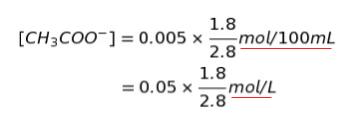
明らかに 5.0 × 10-2 よりも「小さく」なるので、㋑ は 3.2 × 10-2 です。正解は 3 or 4 です。
ナトリウムイオン濃度が 3.2 × 10-2 mol/L になるように、0.50mol/L の NaOH 溶液を 何 mL 入れるかといえば、6.4 mL と考えられます。㋒ は 6.4 mL です。
以上より、正解は 4 です。

コメント