溶液の濃度の単位は mol/L(モルパーリットル) です。mol L-1 と表すことも多いです。溶けているものが 1L 中に何 mol あるかを表します。
溶液の濃度といえば、まず質量 パーセント濃度を思い出すのではないでしょうか。「溶液 100g 中の、溶質が何g か」という値を示す濃度です。しかしこれだと、1% の塩酸と 1% の水酸化ナトリウムで含まれる物質量が異なり、化学反応を考える時には不便です。化学においては大体 mol/L を用います。
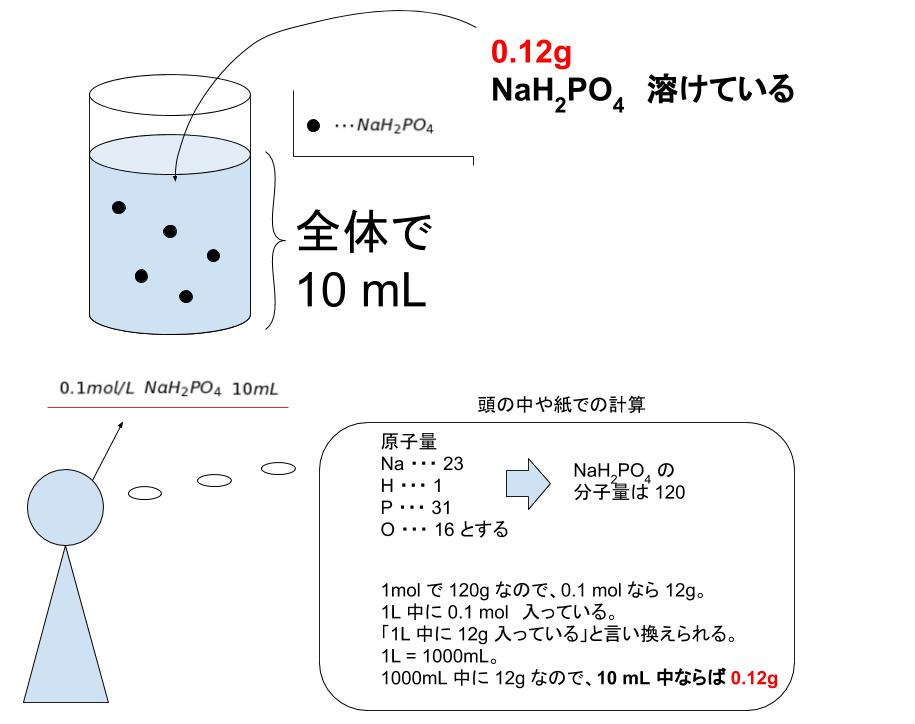
「0.100mol/L リン酸二水素一ナトリウム水溶液(NaH2PO4) 10.00mL」 のように「濃度+物質名+容量」という情報が与えられた時に、以下のようなイメージと、何 mol そこになるか という値が自分でスムーズに浮かぶようにしっかりと理解を深めましょう。
薬学においてよくやる操作は「希釈」です。希釈するたび濃度は変わるのですが、その中の溶質の量は変化していない点に注意が必要です。また、◯倍希釈 といわれたら、もとの水溶液を比で言う 1 として、◯倍になるまで水などの溶媒を加える ということです。
例:0.1 mol/L の NaOH 水溶液 が 10mL ある。
この水溶液を 10 倍に希釈した。
Q1:希釈後、水溶液は 何 mL?
もしも2倍希釈、3倍希釈、49倍希釈だったら、それぞれ水溶液は 何 mL?
Q2:10 倍希釈前の水溶液 10mL 中に、NaOH は 何 mol ある?また、何g ある?
Q3:10 倍希釈後の水溶液 から 10 mL とった。この水溶液 10mL 中に、NaOH は何 mol ある?また、何g ある?
A1
10倍なので 100mL です。2倍なら 20mL、3倍なら 30mL、49倍なら 490mL です。
A2
希釈前 1L 中に 0.1mol なので、10mL 中に 0.001mol です。NaOH の分子量は 40 とします。1mol で 40g なので、0.001mol なら 0.04g です。
A3
まず 10 倍希釈した時点で 0.01mol/L の NaOH 水溶液が 100mL あります。10mL とるので、0.01mol/L の NaOH 水溶液 10mL です。1L で 0.01mol なので 10mL で 0.0001mol です。1mol が 40g なので、0.0001mol なら 0.004g です。
0 の数をしっかり自分で自信を持って書けるように!10-◯ 乗の形になおしてもOK。

コメント