酸化還元反応とは、反応系に存在する電子供与体と電子受容体間での電子の移動にともなっておきる化学反応のことです。
酸化還元反応は、2つの半反応式に分割して記述することができます。以下に例を示しつつ、説明します。酸化還元反応の例として、セリウムイオンと鉄イオンの反応をあげます。式は以下になります。
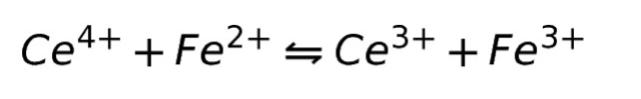
この反応を、2つの半反応式に分解すると、以下になります。
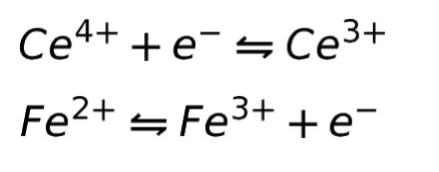
半反応式は、一般に、以下のような式で表現することができます。
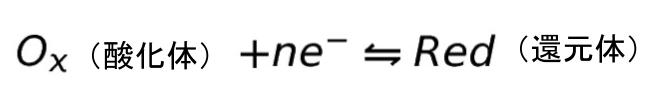
各種の酸化還元対の反応性、すなわち、酸化体になりやすいか、還元体になりやすいかは、電子授受の傾向により決まります。つまり、半反応式における原子の、電子の受け取りやすさにより決まります。その尺度を表すのが、酸化還元電位 E です。以下の、Nernst の式により表されます。
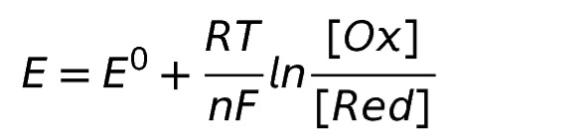
※ Rは気体定数、F はファラデー定数、T は絶対温度
※[Ox]、[Red]は、それぞれ酸化体、還元体の濃度
※ E0 は、標準酸化電位といい、各酸化還元対で固有の値。

コメント