溶解度とは、ある溶媒(水など)に溶けることができる溶質の最大量のことです。溶質が固体の場合、溶媒 100g に溶ける溶質の質量(g)で表すことが多いです。
溶解度積とは、難溶性の飽和溶液における、陽イオン濃度と陰イオン濃度の積のことです。AgCl を例にすると、まず AgCl を水に加えると、わずかに溶解し、以下のような平衡がおこり、平衡状態となります。

と表されます。ここで AgCl が難溶性であることから、[AgCl]はほぼ一定です。そこで式を変形して K[AgCl]=[Ag+][Cl–]とすると、左辺は定数とみなすことができます。Ksp=K[AgCl]=[Ag+][Cl–]と表す時、Ksp を溶解度積と呼びます。Ksp は小さいほど、塩が難溶性であることを示します。
さきほどは、AgCl という、一価のイオン同士でしたが、一般に難溶性電解質を
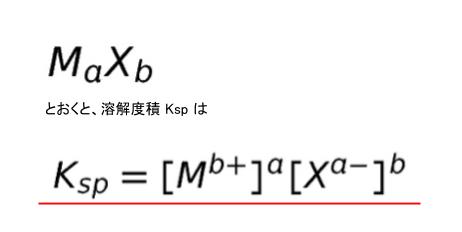
と表されます。
※溶解度積は、一般に Ksp と表します。sp は solubility produnt の略です。
溶解度と溶解度積の間には、以下のような関係があります。


コメント