絶対温度 T において、反応前の系と反応後の系が平衡にある時、その平衡定数 K は、両状態の
標準自由エネルギー(1atm,25℃の時の自由エネルギー)の差ΔG0 で決まります。式で表すと ΔG0 = -RT lnK です。自由エネルギーと平衡定数の関係を表す式として、この式は重要です。
自由エネルギーは、エンタルピーとエントロピーで決まる状態量でした。ΔG0 = -RT lnK の左辺にΔG0 =ΔH0 - TΔS0 を代入して、形を整えると
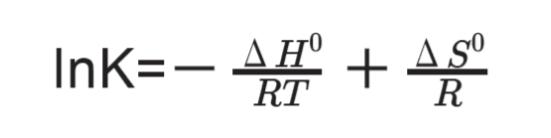
となります。この式を van’t hoff 式といいます。van’t hoff 式は、平衡定数と温度の関係を示す式です。また、平衡定数と標準エンタルピーや標準エントロピーの関係を示す式ともいえます。
van’t hoff 式 の具体的な使い方は「異なる温度における平衡定数を2点~数点測定し、横軸 1/T 、縦軸を lnK としたグラフをプロットすることで、標準エンタルピー変化 ΔH0 や、標準エントロピー変化 ΔS0 を求める」です。イメージとしては下図のようになります。
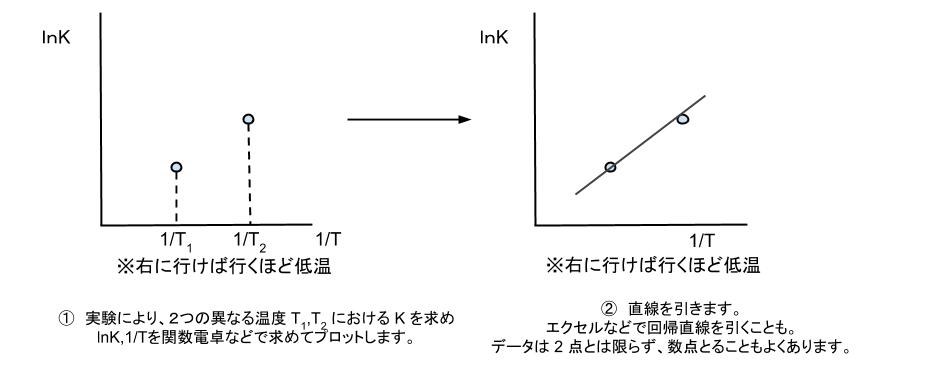
直線の傾きが、-ΔH0/R となります。R は定数なので、ΔH0 を計算することができます。
直線を延長して、y 軸との交点を読めば、ΔS0/R がわかります。
演習問題 99回 問2

コメント