軌道(原子軌道と呼ばれることもある。)とは、電子の存在しうる領域の事です。
その領域は、波動方程式と呼ばれる式を解いた時に出てくる解 = 波動関数で表されます。エネルギーが1番低い時の「波動関数1」、エネルギーが2番目に低い時の「波動関数2」、、、といった解です。この解の具体的な式の形は、係数がごちゃごちゃしている ex , sinx , cosx の積や和です。イメージとしては、グラフにしたら波打っているイメージで OK です。
各軌道に入ることができる電子の数は、2つです。それぞれの電子の、スピンと呼ばれる固有の角運動量が逆でなければならないという法則が、自然界においての原理として成り立っています。Pauli(パウリ)の排他原理と呼ばれる原則です。
スピンが逆でなければならないということを、喩え話で説明すると、電子1つ1つが自転しており、1つの部屋(=1つの軌道)に入れる電子は2つだが、2つは必ず逆向きにくるくる回っているというイメージになります。1つの部屋に入った、スピンの向きが逆である2つの電子のことを電子対と呼びます。
電子がいくつかある時は、エネルギーが一番低い軌道から順に電子が入っていきます。これを構成原理といいます。構造原理と呼ばれることもあります。等しいエネルギーの複数の軌道がある時は、次の様なルールに従い、電子が入っていきます。
まず、それぞれの軌道に同じ方向のスピンを持った電子が1つずつ入った後、逆方向のスピンを持った電子がそれぞれの軌道に入って電子対になっていきます。これは Hund(フント)の規則と呼ばれます
ここまでの話は、1つの原子における電子の軌道に関してです。
次に2つの原子がつくり上げる共有結合について考えます。
例として、1つの H(電子が1つ)と1つの H(電子が1つ)が共有結合を作り上げることを考えます。1つの電子は、エネルギーが最低の軌道である s 軌道(sはsharpの略。)に入っています。そして、軌道はまだ2つ電子が入りきっていません。
2つの H 原子が近づく時、2つの s 軌道も近づきます。この時、軌道というのは波っぽい関数であったことを考えると、うまく2つの関数が重なりあうと、波が大きくなったり小さくなったりすると考えることができます。
少し堅苦しい言葉で表すと、位相がそれぞれの軌道において同じであれば互いに強め合い、位相がそれぞれの軌道において異なれば、互いに弱め合います。
互いに強め合う = その場所に電子が存在する確率が高くなる = 2つの電子が、強め合う領域にいる = 必然的に2つの原子が近くにいる → これを「共有結合が生成している」と呼びます。
この話は、2つの原子における電子の軌道に関してでした。
最後に、多原子における電子の軌道に関して3つ例をあげます。
1つめの例として BeH2 を上げます。Be には電子が 4 個、H には電子が 1 個あります。
エネルギーが低い方から軌道をあげていくと、1s,2s,2p,2p,2p、、、です。2pが3つあるのは、同じエネルギ-のため同じ名前です。便宜上 x , y , z が下付き文字でつくことが多いです。(参考:続きは3s,3p,3p,3p,4s,3d,3d,3d,3d,3d,4p,4p,4p,5s・・・です。p は principal , d はdiffuse、f は fundamental の略です)
Be の電子は1s,2s軌道に2つずつ入っています。開いている軌道がなく、このままでは「BeとHの接近」→「軌道の重なりあいによる新たな軌道生成」がおきたとしても、電子が入りきらず、結合は生じません。
ここで、2s軌道と2p軌道はそれほどエネルギーが変わらないことから、2s軌道に入っている2つの電子の内1つを、2p軌道に渡してしまうことで、2つ軌道を空けることができます。(参考図1)

こうすれば、H との結合を生じることができます。すると、Be の 2s 軌道と H の 1s 軌道との強めあいによる結合が1つとBe の 2p 軌道と H の 1s 軌道との強めあいによる結合 1 つが生成されると予想されます。さらに、2s 軌道及び 2p 軌道の形から、結合は 90 度であると予想されます。
しかし、実際には、BeH2 は直線上の分子であることが測定によりわかっています。これはなぜかといえば、電子と電子は共に負電荷を持っており、反発しあうためできるだけ離れようとするからです。つまり、軌道という概念だけでは分子の結合を説明しきれないといえます。
そこで、説明するための便利な概念として考えだされたのが混成軌道です。すなわち、一つの原子の原子軌道と他の一つの原子軌道により、分子軌道ができるように、同一原子上のいくつかの原子軌道を混ぜあわせても、新しい軌道(=混成軌道)ができると考える概念です。
先程のベリリウム上の、2s軌道と、2p軌道を混ぜ合わせることで、s性50%、p性50%の sp 混成軌道ができます。
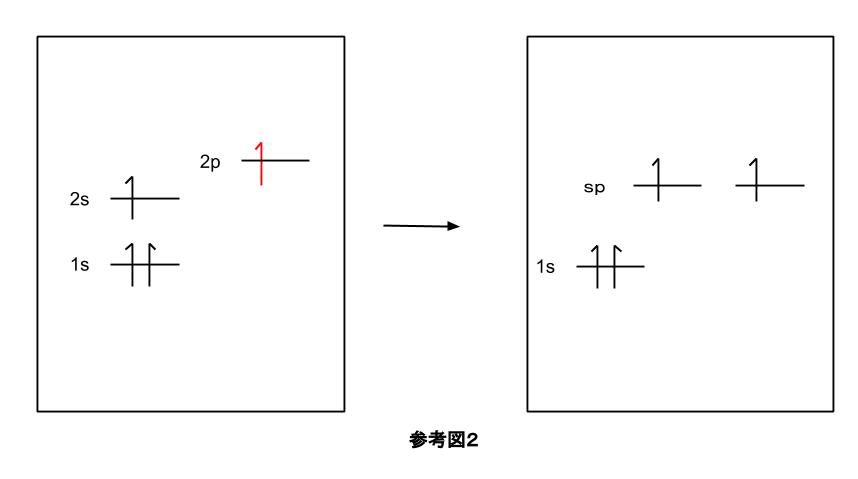
この sp 混成軌道の形も又、方程式を解いた式をグラフにしたものであり、2つの非対称なローブが180°の角度で互いに反対方向を向いているものとなります。
同様に BH3 について考えます。
BH3 において、B は電子5つであり、1s軌道に2個、2s軌道に2個、2p軌道に1個電子が入っています。
ここで、2s軌道の2つの電子のうち1つが、2p軌道に行き、2s,及び2p軌道2つの併せて3つの軌道が混成することで、sp2 混成軌道と呼ばれる3つの軌道ができます。
この形はそれぞれの非対称なローブが 120°ずつの角度を成します。一つ余った2p軌道は、sp2 軌道とは垂直な軌道となります。この軌道における電子対が、分子におけるπ結合の生成に関与することになります。
最後に CH4 について考えます。
CH4 において、Cは電子6個であり、1s軌道に2個、2s軌道に2個、2p軌道に2個電子が入っています。
ここで、2s軌道の2つの電子のうち1つが、2p軌道に行き、2s、及び2p軌道3つの併せて4つの軌道が混成することで、sp3 混成軌道と呼ばれる4つの軌道ができます。4つの軌道は、それぞれ正四面体を構成するような軌道となります。
まとめ : 同じ原子上の軌道を混ぜ合わせることで、違った形をもつ新しい混成軌道ができる。
s軌道1つ、p軌道1つからは、sp 混成軌道2つができる。
s軌道1つ、p軌道2つからは、sp2 混成軌道3つができる。
s軌道1つ、p軌道3つからは、sp3 混成軌道4つができる。

コメント