問 題
0.200 mol/L 酢酸 50.0 mL に 0.100mol/L 水酸化ナトリウム水溶液 50.0mL を加えた。その後、この混合溶液に対して 1.00mol/L 塩酸を 1.00mL 加えた溶液の pH に最も近い値はどれか。1つ選べ。ただし、酢酸の pKa=4.70、log2 = 0.301、log3 = 0.477とする。
- 2.01
- 3.41
- 4.52
- 4.70
- 4.93
解 説
酢酸に水酸化ナトリウムを加えているため「酢酸+酢酸ナトリウム」となります。これは「弱酸+弱酸の塩」なので緩衝溶液です。緩衝溶液に塩酸を加えて、pH は何だという問題です。緩衝溶液、pH と来たら Henderson-Hasselbalch (ヘンダーソン-ハッセルバルヒ)の式です。今回は酸性緩衝液なので「pH = pKa + log [イオン形]/[分子形]」 (酸性緩衝液の場合)を思い出します。
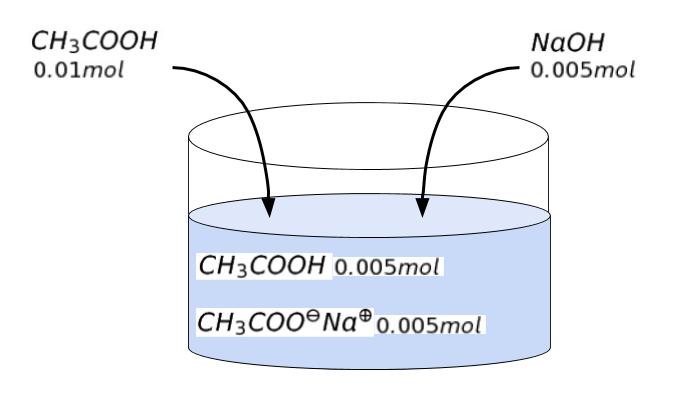
問題文より、酢酸の pKa = 4.70 です。後は溶液中のイオン形、すなわち「CH3COO–」と、分子形[CH3COOH]の物質量がわかればOKです。問題文の順に考えていきます。まず 0.200 mol/L 酢酸 50.0mL に、0.100mol/L の NaOH 50.0 mL を加えています。
酢酸(CH3COOH) は 0.2 × 0.05 = 0.01 mol 存在していました。一方、NaOH は 0.1 × 0.05 = 0.005 mol です。CH3COOH + NaOH → CH3COONa + H2O です。
反応後は、CH3COOH が 0.005 mol、CH3COONa が 0.005 mol 存在するとわかります。※ CH3COONa は塩なので、溶液中で全て CH3COO– + Na+ に電離していると考えます。
この混合溶液に HCl 1.00mol/L を 1.00mL 加えています。HCl は 0.001 mol です。HCl は強酸なので、完全に電離していると考えられます。つまり H+ が 0.001 mol、Cl– も 0.001 mol 加えられたということです。
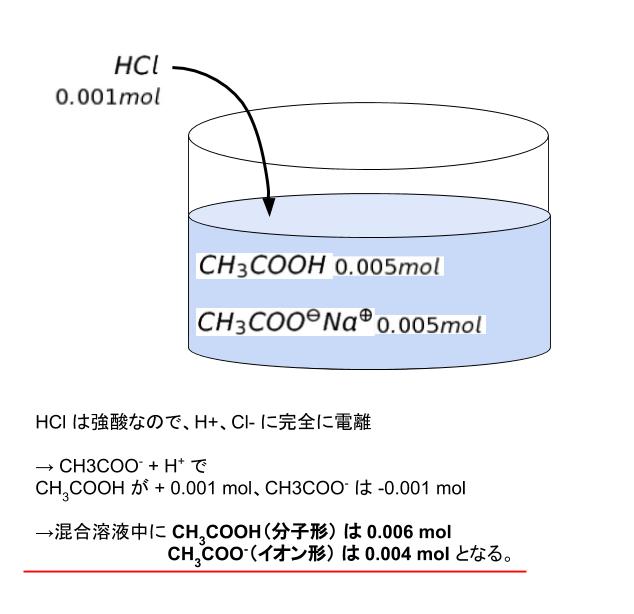
後はヘンダーソンの式に代入します。「pH = pKa + log [イオン形]/[分子形]」に、pKa = 4.70、[イオン形]に 0.004、[分子形]に 0.006 を代入します。

以上より、正解は 3 です。
参考)分析化学まとめ 緩衝作用

コメント