問 題
ある分子X(初濃度100mmol/L)が分解して2分子のY(初濃度0mmol/L)が生成する反応
![]()
において、下のグラフはXの濃度の時間変化を表す。この反応に関する記述のうち、正しいのはどれか。2つ選べ。
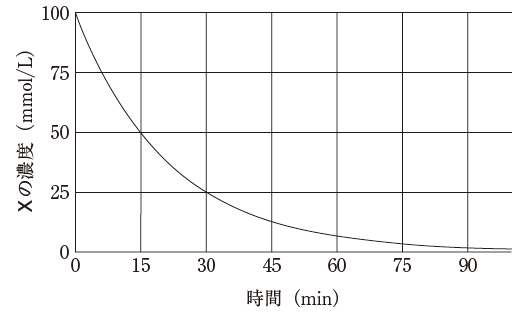
- 横軸の時間10分でのYの濃度は、同じ時間のXの濃度の2倍である。
- この分解反応は、一次反応である。
- この分解反応の速度定数の符号は負である。
- 同じ時間でのXとYの濃度変化曲線の接線の傾きの絶対値は等しい。
- Xの濃度が初濃度の1/2になるまでにかかる時間は、Yの濃度が100mmol/Lから150mmol/Lになるまでにかかる時間と等しい。
正解.2, 5
解 説
グラフから、濃度が変化しても半減期が一定の 15 分であると読み取れます。
選択肢 1 ですが
10 分であれば、まだ X が 100 → 50(この時 Y が 0 → 100) になっていません。よって、選択肢 1 は誤りです。
選択肢 2 は妥当な記述です。
濃度により半減期が変化していないからです。
選択肢 3 ですが
一次反応なので -dC/dt = kC と表すことができます。また、半減期は大体 0.7/k です。半減期が 15分と正なので、k も正と判断することができます。よって、選択肢 3 は誤りです。
選択肢 4 ですが
X はだんだん減っていき、Y はだんだん増えていきます。そして X → 2Y なので、増え方は Y の方が急であると考えられます。よって、選択肢 4 は誤りです。
選択肢 5 は妥当な記述です。
半減期は 15 分です。そして、Y が 100 → 150 になるのは、X 50 → 25 になるまでにかかる時間です。すなわち1半減期なので 15 分です。確かに等しいとわかります。
以上より、正解は 2,5 です。

コメント