問 題
25℃において固相が十分に存在する条件下、pHと弱電解質Aの分子形とイオン形の溶解平衡時の濃度の関係を図に表した。以下の記述のうち、正しいのはどれか。2つ選べ。
ただし、弱電解質Aの分子形とイオン形の溶解平衡時の濃度比はHenderson-Hasselbalchの式に従い、弱電解質Aの溶解やpH調整に伴う容積変化は無視できるものとする。必要ならば、log2=0.30、log3=0.48、101/2=3.2を用いて計算せよ。
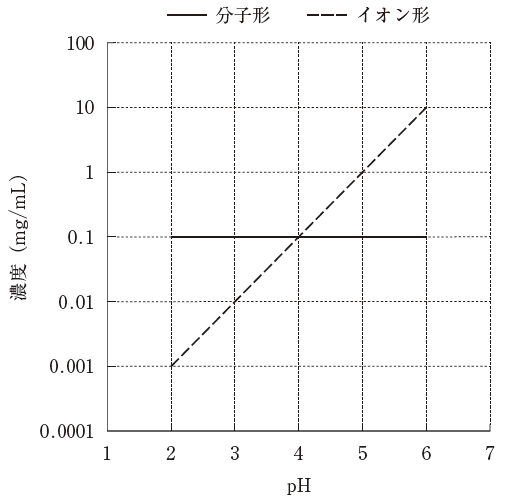
- 弱電解質Aは弱酸性化合物である。
- 弱電解質AのpKaは2.0である。
- 25℃において、pH7.0のときの弱電解質Aの溶解度は、pH6.0のときの溶解度の約10倍になると予想される。
- 25℃において、pH1.0のときの弱電解質Aの溶解度は、pH2.0のときの溶解度の約1/10倍になると予想される。
- 25℃において、弱電解質A 5mgを水1mLに分散させたとき、pH5.5以上になると全量が溶解すると予想される。
解 説
ヘンダーソン・ハッセルバルヒの式は、以下の式です。
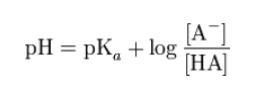
選択肢 1 ですが
pH が 4 の時、ちょうど分子とイオン形が1:1です。pH が 3 の時、分子形:イオン形が10:1となっています。つまり酸性側になると、分子形が多いです。これは 弱酸性化合物と考えられます。なぜなら、塩基性化合物であれば、酸性側に傾いた時、酸塩基反応でイオン形が多くなるはずだからです。よって、選択肢 1 は誤りです。
選択肢 2 ですが
ヘンダーソン・ハッセルバルヒの式より、分子とイオン形が1:1の時の pH が、pKa です。従って、pKa = 4 です。2.0 ではありません。よって、選択肢 2 は誤りです。
選択肢 3,4 ですが
固相が十分存在する、ということなので、溶解度は、イオン形がどれくらい溶けるかで大きく変わります。pH が 6.0 → 7.0 になると、点線を伸ばせば、イオン形が 10mg/mL → 100mg/mL 溶けるようになるとわかります。すると 約 10 倍溶けるようになると考えられます。
一方、pH 2.0 → 1.0 の場合、もともとほとんどイオン形は溶けておらず、この場合の溶解度は、分子形がどれくらい溶けているかでほぼ決定しています。イオン形が 0.001 しか溶けていなかったものが、さらに 0.0001 しか溶けなくなろうと、溶解度はほぼ変化しません。
以上より、選択肢 3 は妥当な記述です。
選択肢 4 は誤りです。(類題 99-174)
選択肢 5 ですが
対数目盛りの真ん中は、半分ではありません。縦軸が表しているのは、下から 10-4 、10-3 、、、102 です。濃度 1~10 の真ん中は 101/2 ≒ 3.3 です。従って、濃度 5mg/mL を超えるためには pH が 5.5 よりももう少し大きくなる必要があると予想されます。よって、選択肢 5 は誤りです。
以上より、正解は 1,3 です。

コメント