問 題
pKa=5.2の1価の弱酸性薬物水溶液に関する記述のうち、正しいのはどれか。1つ選べ。ただし、イオン形薬物はすべて溶解するものとする。
- pH5.2の溶液中では、分子形の薬物のみが存在する。
- pH7.2の溶液中では、イオン形薬物分率は約1%である。
- pH6.2における溶解度は、pH5.2と比較して約10倍である。
- pH7.2における溶解度は、pH5.2と比較して約50倍である。
- pH7.2における溶解度は、pH5.2と比較して約100倍である。
解 説
選択肢 1 ですが
ヘンダーソン・ハッセルバルヒの式
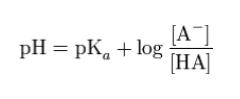
によれば、pH = 5.2、pKa = 5.2 であれば log の項が 0 つまり、[Aー]/[HA] = 1なので、イオン形と分子形が 1:1 で存在します。分子形のみが存在するわけでは、ありません。よって、選択肢 1 は誤りです。
選択肢 2 ですが
ヘンダーソン、ハッセルバルヒの式によれば、pH = 7.2、pKa = 5.2 であれば log の項が 2 つまり、[Aー]/[HA] = 100 なので、イオン形と分子形が 100:1 で存在します。すると、イオン形が約 99 % です。よって、選択肢 2 は誤りです。
選択肢 3~5 ですが
「総溶解度は、溶解度を s とおくと、s × (1 + 10pH-pKa)」と表すことができます。すると、pH = 5.2 pKa = 5.2 であれば 2s、pH = 6.2 pKa = 5.2 であれば、大体 10s、pH = 7.2 pKa = 5.2 であれば、大体 100s と表せます。
「 」の公式を知らなかったり、忘れていた場合は 選択肢 1,2 を活用して、以下のように考えることが期待されていると思われます。
例えば、食塩のように、中性の物質で溶解度が 30 なら、水100gに食塩入れると、30 g 溶けて、それで終わりです。ところが、溶かす物質が弱酸性薬物 HA で、溶解度が 30 だったとします。すると、水100gに HA が、30 g まず溶けます。次に、水中で HA は、H+ と A– に解離します。
ここで例えば、pH = pKa であるような場合、つまり分子形とイオン形の比率が 1:1 になる環境だったとします。水中における HA の分子形は、固体の HA がたっぷりあるので溶解度分、つまり 30 だけいつも溶けていると考えられます。すると 1:1 で、イオン形も、30、水中にあるはずです。このイオン形は、HA が解離したものなのだから、あわせると 30+30=60 HAが、水中に溶けた ということができます。
分子形と、イオン形の比率はヘンダーソン・ハッセルバルヒの式に従うので、pH = 7.2 で、pKa = 5.2 だったら、選択肢 2 よりイオン形の方が 100 倍 存在します。この例でいえば 3000 溶けているということになります。このイオン形は、HA が解離したものなのだから、あわせると 30+3000=3030HA が、水中に溶けた ということができます。すると、pH = 7.2 の時は、pH = 5.2 の時の大体50倍の溶解度といえます。
以上より、正解は 4 です。

コメント