問 題
気体分子 A と気体分子 B が発熱反応して、気体分子 C を生成する、次の可逆反応を考える。
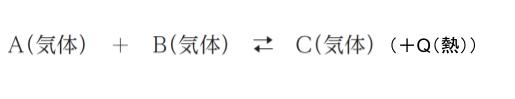
容積を変えられる密閉容器に、A 及び B を入れ、ある体積、温度及び圧力に保ったところ、C が生成し、平衡状態となった。この平衡状態に対し ㋐ ~ ㋓ の操作を行ったとき、操作とそれに伴う C の量の変化の組合せとして最も妥当なのはどれか。ただし、全ての気体は理想気体の挙動を示すものとする。
㋐ 温度を上げるが、全圧が変わらないよう容積を増やす。
㋑ 温度は変えないまま容積を減らし、全圧を上げる。
㋒ 反応を加速する触媒を少量添加する。容積を触媒の体積分だけ増やし温度、全圧は変えない。
㋓ ヘリウムガスを加えるが、容積を増やし、温度、全圧は変えない。
Cが減少する Cの量は変わらない Cが増加する
1. ㋐ ㋒、㋓ ㋑
2. ㋐ ㋓ ㋑、㋒
3. ㋐、㋓ ㋒ ㋑
4. ㋑ ㋒、㋓ ㋐
5. ㋑、㋓ なし ㋐、㋒
解 説
ルシャトリエの原理についての理解が問われています。ルシャトリエの原理とは「平衡状態にある可逆反応において条件を変化すると、その変化を和らげるような方向に平衡は移動する」という原理です。
この反応における正反応、つまり右側に進む反応に注目すると、A+B → C となっています。係数に注目すると「左辺が 1+1 = 2」,「右辺が 1」です。「係数が減る」ので体積は減る反応です。圧力も減ります。また、問題文より、「右側に進むと発熱」します。以上をふまえて、各操作について検討します。
操作 ㋐ は、要するに温度を上げています。温度が上がらないように平衡は移動します。よって「左に移動」です。C は減少します。
操作㋑は、要するに圧力を上げています。圧力が下がるように平衡は移動します。よって「右に移動」です。Cは増加します。
操作㋒は、触媒の添加だけなので平衡は移動しません。Cは変わりません。
操作㋓は、希ガスの添加です。全圧が変わっていないことから各気体成分の分圧は減ります。よって圧力が上がるように平衡は移動します。つまり左に移動です。C は減少します。
以上より、C が減少するのが、㋐、㋓です。変わらないのが㋒です。C が増加するのが㋑です。正解は 3 です。
類題 H27no32(一般職教養)

コメント