問 題
固体-液体系の相図に関する次の記述の ア イ に当てはまるものの組合せとして最も妥当なのはどれか。
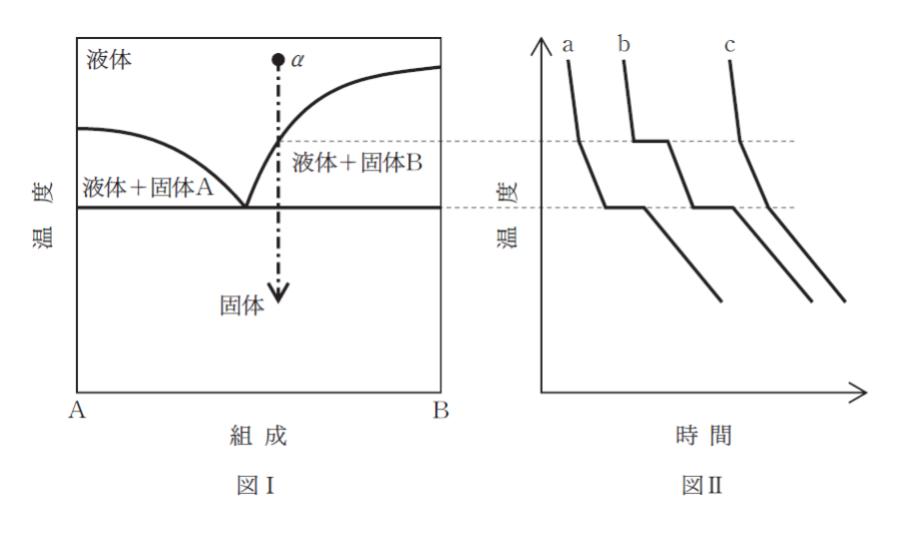
「図Ⅰは、大気圧下における、A と B の2成分からなる固体-液体系の相図である。ギブズの相律によれば系の自由度を F、 相の数を P とすると、2成分の系においては F = ア が成立する。
また点 α の組成の融液を冷却するとき時間に対する温度の変化を模式的に表すと、図の イ のようになる。ただし冷却は十分ゆっくり行っており、過冷却のような現象は考えないものとする。」
ア イ
1. P + 2 a
2. P + 2 b
3. P + 2 c
4. 4 - P a
5. 4 - P b
解 説
相律についてはリンク先がまとまっていますので、参考にしてみてください。(リンク先は「薬学まとめました 3-1 2) 相平衡と相律」
ギブスの相律は、F(自由度)= C(成分の数)-P(相の数)+2 という式のことです。本問では、成分の数が 2 なので、F = 4 – P です。よって、正解は 4 or 5 です。
次に、冷却過程について考えます。
点 a から、温度を下げていくとまず、融点の高い成分 B が凍り始めます。「融点が、成分 B の方が高く、先に凍り始める」 ことは、図Ⅰにおいて、左端(組成がAのみ。)と右端の点(組成がBのみ)を比較することから読み取ります。
B を溶媒と見て、A が溶けていると考えれば、B の凝固に伴い、B に対する A の濃度が大きくなります。この結果、B の凝固点降下が大きくなっていきます。従って、温度は下がり続けます。
B が完全に固体になったら、今度は A(まだ液体) が更に冷えていきます。A が凍って固体になる時には、A の状態変化にエネルギーが使われるため、温度の変化は平らになります。最後に、全てが固体になったらさらに冷えていきます。まとめると「↘、↘、→↘」 という変化です。図Ⅱ における a が正しい図です。
以上より、正解は 4 です。

コメント