問 題
大気圧下 600K における気体分子 A の反応
A (気体) → B (気体)+C (気体)
に関する次の記述の ア イ に当てはまるものの組合せとして最も妥当なのはどれか。ただし気体分子 A の分圧は大気圧に対して十分小さいものとする。
「反応時間 t[s] における気体分子 A の分圧 pA[Pa] を計測した。反応前における気体 A の分圧を p0[Pa]とし、loge(pA/p0) を t に対してプロットしたところ、図のようになった。プロットが直線上にのることからこの反応はア 反応であり、反応速度定数は イとなる。」
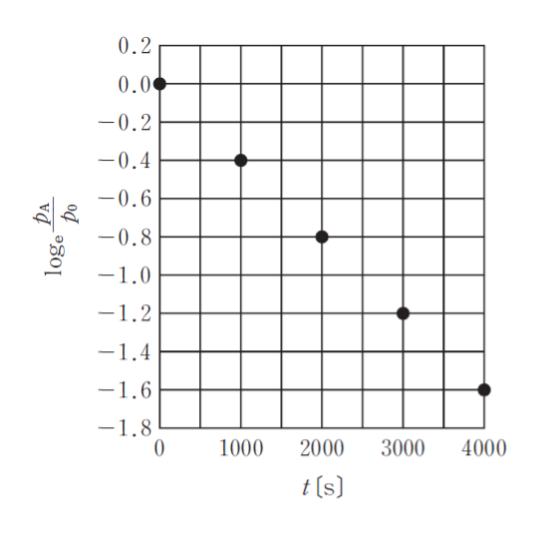
ア イ
1. 1次 4.0× 10-4s-1
2. 1次 2.5× 10-3s-2
3. 1次 2.5× 103s-1
4. 2次 4.0× 10-4Pa-1・s-1
5. 2次 2.5× 103Pa-1・s-1
解 説
反応速度の公式は、覚えていたとします。以下の3つの公式です。
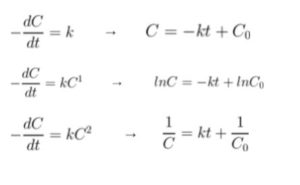
(それぞれ上から、0次、1次、2次反応。C は濃度。k は、反応速度定数。t は時間。)
グラフの縦軸に ln があることから真ん中の公式である、lnC = -kt + lnC0 を連想します。C と P の違いや分数の部分が気になると思いますが無視して「きっと一次反応で、反応速度定数は、グラフの傾きだろう」と考えてもかまいません。
きちんと考えるのであれば、まず気体において、濃度と分圧は比例します。それをふまえて 公式を変形すると、lnC – lnC0 = -kt とすれば、log の引き算は割り算だから、lnC/C0 = -kt となります。
ここで C を pA, C0 を p0 とすれば、ln pA/p0 = -kt となり、反応速度定数 k というのは、グラフの傾きである、と考えられます。また、この公式は 1 次反応において成り立つため、ア が 1次 であるとわかります。
傾きは、t が 1000 増えるごとに、0.4 下がっている ので、0.4/1000 = 4.0 × 10-4 となります。つまり、イ が 4.0 × 10-4 です。
以上より、正解は 1 です。
類題 H25no14

コメント