問 題
Cd2+ を含む水溶液と Ni2+ を含む水溶液に、緩衝液を用いて pH を調整した後、硫化水素を吹き込む。これらの水溶液の pH を1に調整した場合と pH を4に調整した場合における沈殿の生成に関する記述の組合せとして最も妥当なのはどれか。
ただし Cd2+ 及び Ni2+ の濃度は、いずれも 1L 当たり 0.01 mol 程度であり、CdS 及び NiS の溶解度積は、それぞれ5.0× 10-28 mol2/L2 及び 2.0× 10-21 mol2/L2 である。
また硫化水素濃度は、ほぼ飽和状態の 0.1mol/L であり、硫化水素の第一解離定数を 1.0× 10-7 mol/L 第二解離定数を1.3× 10-13 mol/L とする。
pH を1に調整した場合/
pH を4に調整した場合
1. CdS のみ沈殿し Ni2+ は沈殿しない。/
CdS NiS とも沈殿する。
2. CdS のみ沈殿し Ni2+ は沈殿しない。/
NiS のみ沈殿し Cd2+ は沈殿しない。
3. Cd2+ Ni2+ とも沈殿しない。/
CdS のみ沈殿し Ni2+ は沈殿しない。
4. Cd2+ Ni2+とも沈殿しない。/
CdS NiS とも沈殿する。
5. NiS のみ沈殿し Cd2+ は沈殿しない。/
CdS のみ沈殿し Ni2+ は沈殿しない。
解 説
CdS、NiS は、以下のような平衡状態を取ります。
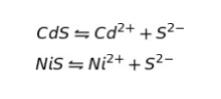
溶解度積を Ksp とおくと、CdS 及び NiS の溶解度積は
Ksp(CdS) = [Cd]2+・[S]2-
Ksp(NiS) = [Ni]2+・[S]2- です。
問題文より、[Cd]2+・及び [Ni]2+・は、0.01 mol/L です。また、それぞれの Ksp もわかっています。よって、飽和状態における [S]2- も、計算でわかります。
CdS が溶けて飽和状態の時は[S]2- が 5.0 × 10-26 です。
NiS が溶けて飽和状態の時は[S]2- が 2.0 × 10-19 です。
一方、pH の違いによって、H2S がどれくらい電離するか、すなわち[S]2- の濃度が変化するため pH 1 の時の[S]2- と、pH 4 の時の[S]2- を計算します。
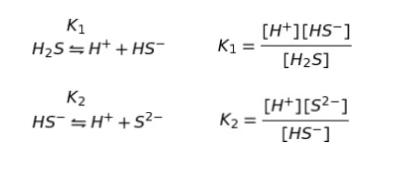
K1,K2 は、上のように表されることから、K1 × K2 を考えると(※ 二段階解離でそれぞれの解離定数を掛けるのは有名なパターンなので、覚えておく必要があります。)

pH = 1 なら、[H]+ が、1.0 × 10-1 なので、[S]2- は、1.3 × 10-20 です。これは、NiS では OK ですが CdS では、S2- が多すぎます。つまり、NiS は溶けたままで、CdS は溶けずに沈殿します。
一方、pH = 4 なら、[H]+ が、1.0 × 10-4 なので、[S]2- は、1.3 × 10-13 です。 これは、NiS、CdS どちらの溶解度積で見ても S2- が多すぎます。つまり、これ以上 S が、S2- になることはない。言い換えると、溶けていられない。よって、両方とも沈殿します。
まとめると
pH = 1 → NiS 溶けたまま。 CdS 沈殿
pH = 4 → NiS,CdS ともに沈殿 です。
以上より、正解は 1 です。

コメント