問 題
1 mol のメタン、2 mol の酸素、20 mol の窒素からなる混合気体がある。この混合気体を 1 atm(1×105 Pa), 300 Kで断熱容器中に供給し、定圧条件で完全燃焼させたとき、断熱容器中のガスが達する最高温度を表の熱力学データを用いて求めるとおよそ何 K か。ただし、表中の ΔHf は 300 K における生成エンタルピー, Cp は定圧モル熱容量であり、生成エンタルピー, 定圧モル熱容量とも温度によらず一定とする。
- 1130 K
- 1270 K
- 1430 K
- 1570 K
- 2170 K
解 説
まず、完全燃焼するのはメタンです。その他の気体についてですが、酸素は燃焼しません。次に窒素ですが、300K = 27℃です。空気中の 80% を占める N2 がライターの火を軽くつけるだけで燃焼したら大問題です。窒素も燃焼しません。
本問は2ステップで解く必要があります。
『step1』:1 mol のメタンを完全燃焼した時に、何 kJ 熱量が生じるかを求める。
『step2』:その熱量で、混合気体がどれくらい温度が上昇するかを求める。
まず step1 について「CH4 + 2O2 → CO2 + 2H2O + Q(kj)」の Q を求めます。生成熱がわかっているので、以下のような式が材料として用意できます。
C+2H2 → CH4 -75
C + O2 → CO2 -393
H2 + 1/2 O2 → H2O -242
後はうまく並べて足せば OK です。「うまく並べて足す」というのは具体的には H25no12解説も参考にしてください。
ゴールの式と材料の式を見比べて
・式1の左右を逆にして
・式2は CO2 がいい場所なのでそのままにして
・式 3 は H2O の係数を合わせるために両辺を 2 倍します。

そして足せば
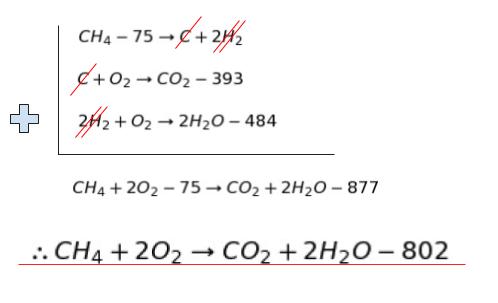
約800kJ の熱量が混合気体に与えられます。step1 終了です。以下、step2 について考えてます。
表より、1mol のメタンは 1K 上がるのに 35J
2mol のO2 は 1K 上がるのに 60J
20mol の N2 は 1K 上がるのに 600J 必要です。
従って、1000K の上昇に、35+60 + 600 = 695kJ ≒ 700kJ かかります。ここまでで混合気体の温度は 1300K に上昇し、残りの熱量が 100kJ ぐらいとなります。
1000K 上昇に 700kJ かかるのであれば、100K 上昇に 70kJ ほど必要ということです。残りの熱量が 100kJ ほどあることから考えて、1300K からさらに 100K ~ 150K 程度の上昇と大雑把に評価できます。つまり、1400K ~ 1450K 付近です。
以上より、正解は 3 です。

コメント