問 題
次の反応①〜⑤におけるエンタルピー変化 ΔH1 〜ΔH5 を用いて、メタン分子の C-H 結合の平均結合エネルギーを求めると何kJ/molになるか。ただし ΔH1 〜ΔH5 は標準状態での値である。
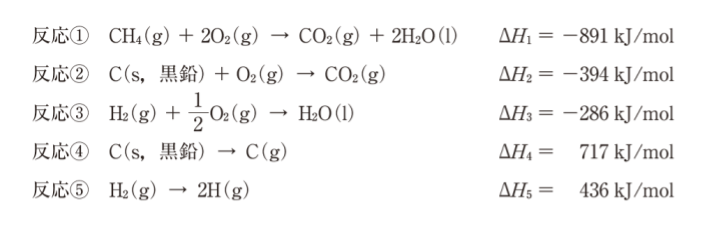
- 184 kJ/mol
- 267 kJ/mol
- 416 kJ/mol
- 577 kJ/mol
- 736 kJ/mol
解 説
C-H 結合 という単語と、反応 ①~⑤ を眺めてみて、下のようなイメージを考えます。
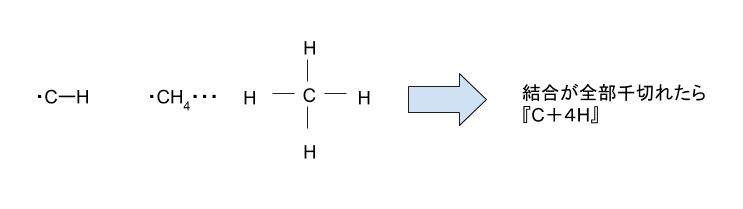
CH4 → C + 4H + ?kJ という関係がわかれば、4つの C-H 結合の持つエネルギーがわかるのではないかと考えます。この式の作り方は、反応①~⑤が与えられているためこれらをうまく並べて足せばOKです。「うまく並べる」とは具体的には2つの step を経ます。それぞれの step について以下説明します。
step1:「ゴールの式の一部」が「反応のうち1つだけにしか出てこない」ものを見つけて「式における左右を揃えて」並べる。
 係数が違う 反応⑤については、両辺を 2 倍して ゴールの式と係数をあわせておきます。⑤’ 2H2(g)→4H(g) ※熱も 2倍します。ΔH5’= 436 × 2 = 872kJ/mol です。
係数が違う 反応⑤については、両辺を 2 倍して ゴールの式と係数をあわせておきます。⑤’ 2H2(g)→4H(g) ※熱も 2倍します。ΔH5’= 436 × 2 = 872kJ/mol です。
step2:「ゴールの式に出てこないもの」は「右と左に散るようにする。」※その際うまく係数が 右、左それぞれ足したら同じになるようにがんばります。
C(s, 黒鉛)に注目すると、反応②と反応④に出てきています。反応④は step1 でいい並びなので、反応 ② の左右を逆にします。②’ CO2(g) -394kJ/mol → C(s,黒鉛)+ O2(g) と書き換える ということです。こうすると、うまいこと反応①と反応②でゴールの式に出てこない「CO2(g)」が右左にうまく散ります!
後は 「H2O」がゴールには不要です。H2O は反応①と反応③に出てきており反応①は step1 でいい並びです。よって、反応③を左右入れ替えて、係数合わせで 両辺を2倍します。③’ 2H2O(l) ー572 → 2H2(g) + O2(g)
以上でうまく並べ終わりました。以下のようになります。
 並べたら、全部足せば答えが出ます。この時、左と右に同じものがあれば、消してOKです。するときれいに消えて、ゴールの式と求めたい数値が出てきます。
並べたら、全部足せば答えが出ます。この時、左と右に同じものがあれば、消してOKです。するときれいに消えて、ゴールの式と求めたい数値が出てきます。

よって、4 つの C-H 結合で 1664 だから、C-H 結合の平均結合エネルギーは 1664 ÷ 4 = 416 と考えられます。
以上より、正解は 3 です。

コメント