n価の金属イオンをMn+で表し、その金属の水酸化物の溶解度積をKspとする。このとき金属イオンMn+の溶解度とpHの関係を表す正しい式はどれか。ここで、Kwは水のイオン積であり、水中の水素イオンのモル濃度[H+]と水酸化物イオンのモル濃度[OH–]により以下の式で表される。
![]()
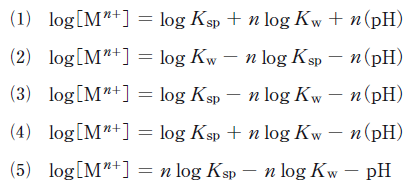
正解 (3)
解 説
金属の水酸化物が溶解する化学反応式は以下の通りで、そのときの溶解度積Kspは次のように表すことができます。
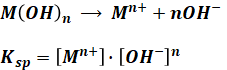
選択肢がどれも対数となっているため、上式の両辺にlogをつけると、

となります。
ここで、上式では[OH–]がありますが、選択肢にはこれがないので消さなくてはいけません。そこで、問題文に与えられた水のイオン積の式を変形すると
![]()
となり、これを先ほどの式に代入すると、

のように計算することができます。
ここで、選択肢のいずれにも登場するpHは、
![]()
で表されるので、求める式は以下のようになります。
![]()

コメント