アミンの性質
アミンはアミノ基(-NH2)を有する化合物で、塩基です。R-NH2という構造からわかるように極性を持ち、分子間で水素結合を形成します。そのため、沸点は似たような分子量のアルカンなどに比べて高くなります。
また、アミンに特徴的な性質といえば、立体反転があります。それを図に表すと以下のようになります。
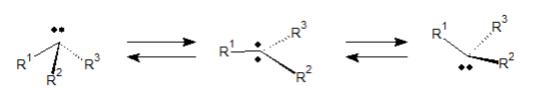
上図の左は、不斉中心を持ったアミンです(非共有電子対もひとつの置換基として扱います)。本来はある化合物(上図左)が対応するエナンチオマー(上図右)に自動的に変化することはありえません。
しかし、アミンの場合に限っては非共有電子対が流動的であるために、上図中央のように3置換基が平面に並ぶ中間体を経て、お互いのエナンチオマーを行き来することができます。これを、立体反転といいます。
この反応速度は速く、不斉アミンは両エナンチオマーの構造を絶えず行き来しているため、ある不斉アミンの一方のエナンチオマーを単離することはできません。
ただし、この反応速度は置換基Rの大きさに依存するため、もし、かさ高い置換基ばかりが付いているアミンであれば立体反転がなかなか起こらず、片方のエナンチオマーを単離することも可能です。
以下、アミンを基質とした代表的な反応を紹介していきます。
アルキル化反応
アミンはN原子が非共有電子対を持つことから、求核性があります。そこで、アミンにハロアルカンを作用させるとSN2反応が起こって、アルキル化します。
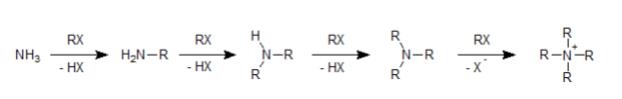
例えば上図のように基質がアンモニアだった場合、最初のSN2反応で第一級アミンが生成します。第一級アミンはアンモニアよりも求核性が高いので(Rが電子供与性基のため)、さらにSN2反応が起こります。
次に生成する第二級アミンはもっと求核性が高く、また反応、次も反応…と次々にSN2反応が進み、求核性がなくなるまで、つまり非共有電子対がなくなるまで反応が進んでしまうため、途中で止めるのは難しい反応です。
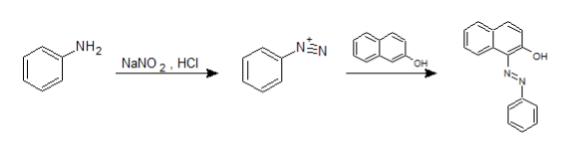
ジアゾカップリング反応
亜硝酸ナトリウム(NaNO2)に塩酸を作用させるとニトロシルカチオン(NO+)が生成します。これを芳香族第一級アミンと反応させると、シアゾニウムイオンとなり、さらにカップリング試薬との反応によりアゾ色素が生成します。
このアゾ色素は赤や紫や青など様々な色を持つ(色は基質や試薬によります)ので、芳香族第一級アミンの確認試験として用いられます。このような反応を、ジアゾカップリング反応といいます。
また、カップリング試薬にはβ-ナフトールやN -(1-ナフチル)-N ‘-ジエチルエチレンジアミンなどがあります。
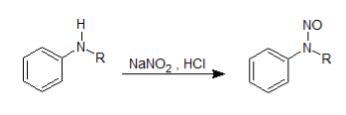
N -ニトロソ化反応
第二級芳香族アミンにニトロシルカチオン(上記同様、亜硝酸ナトリウム+塩酸で生成)を反応させると、ニトロソ化します。N原子上でのニトロソ化なので、N -ニトロソ化反応と呼ばれています。
C -ニトロソ化反応
第三級芳香族アミンで上記の同様の反応をすると、N原子上にニトロソ化できるHがないため、芳香環上のHでニトロソ化します。C原子上でのニトロソ化なので、C -ニトロソ化反応と呼ばれています。
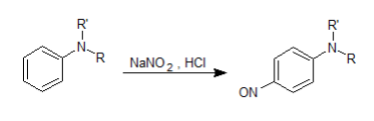
Hofmann脱離
アミンの有名反応のひとつにHofmann(ホフマン)脱離反応があります。これは、アミンのアミノ基と隣の水素を脱離させて、そこが二重結合になるようなアルケン生成反応です。
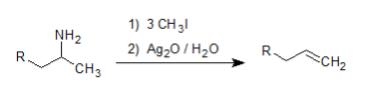
Hofmann脱離がどのように起きているのかというと、以下のような流れになっています。
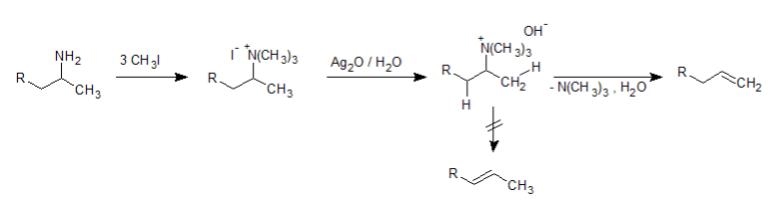
まず最初に、基質のアミンに対してヨードメタンを作用させ、第四級アンモニウム塩を生成させています。これを酸化銀水溶液中で加熱すると、アンモニウム塩がアンモニウムイオンとなり脱離能が上がります。
続いてアンモニウムの部分と近くのHが脱離すれば、そこに二重結合ができてアルケンが生成し、完了です。
このときに脱離するHの候補は2か所あるのですが、この反応では一方が選択的に脱離します。優先的に脱離するのは、立体障害の小さいHです。立体障害が少ないとOH–と反応しやすいためです。
最終的な生成物でみると他方のHのほうが内部アルケンで熱力学的に安定になるのですが、この反応では熱力学的にではなく速度論的に有利なほうが優先されるということです。

コメント