三員環のエーテルのことをエポキシドといいます。最も単純な構造をしたエポキシドの IUPAC 名がオキシランであるため、エポキシドをオキシラン類と呼ぶこともあります。
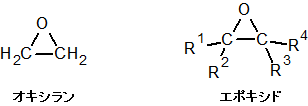
上の構造式を見てもわかるとおり、三員環はその内角(結合角)が 60° です。しかし、一般的な sp3 混成軌道はその結合角が 109.5° なので、60° というのはかなりひずんだ状態といえます。
ひずみが大きいということは、それだけ不安定であるため、エポキシドの反応性はとても高くなります。より具体的にいえば、エポキシドは反応により開環することで、安定な(結合角が 109.5° に近い)化合物へと変わります。
その開裂反応は、酸を触媒とするか塩基を触媒とするかで反応様式が変わりますので、以下で順番に解説します。
酸触媒開裂反応
エポキシドに酸を作用させると、以下のような反応機構によって三員環の開裂が起こります。
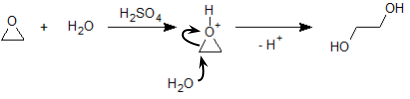
上図では水分子が付加していますが、その水分子が 2 つの炭素のどちらを求核攻撃するかで、その生成物は変わってきます。この反応の場合、たいていは考え得る 2 種の生成物が混合物となって得られますが、エポキシドの構造次第で、それらの生成比は偏ることがあります。
つまり、この反応ではカチオンを経るので、第三級カチオンを中間体とするほうが有利となります。
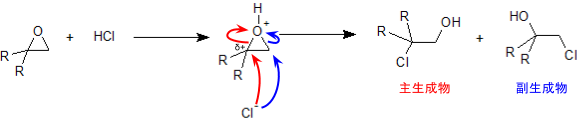
塩基触媒開裂反応
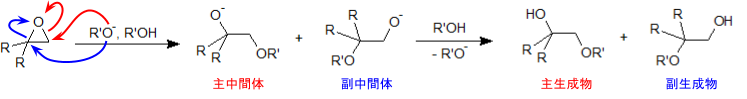
エポキシドに塩基を反応させたときにも、やはり開裂が起こります。この場合は塩基が求核剤となって基質(エポキシド)に求核攻撃を行いますが、その際に求核剤はより立体障害の少ないほうから近づいていきます。
よって、酸を用いたときとは違うメカニズムではありますが、やはり生成物に偏りがでてきます。

コメント