沸点
アルカンの沸点は、その分子量が増えるほど高くなる傾向があります。これは、分子量が大きくなる(=炭素数が増える)ほど、分子間に働くVan der Waals(ファンデルワールス)力が大きくなるためです。
液体であるアルカン同士が強いファンデルワールス力でつながっていれば、そのつながりを引き離して気体に変えるためのエネルギーは多く必要になります。
よって、メタン(bp -162℃)よりはエタン(bp -89℃)のほうが沸点は高く、プロパン(bp -42℃)はさらに沸点が高くなります。( )内のbpは”boiling point”の略で、沸点を指します。
アルカンは常温・常圧下で炭素数1~4なら気体、5~16 or 17なら液体、それ以降は固体になります。ここで16 or 17としたのは、常温の取り方により多少前後するためです。
細かいところまで覚える必要はないと思いますが、ブタンまでが気体で、ペンタンからが液体であることくらいは知っていると良いと思います。
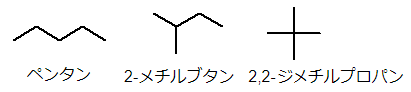
ペンタン、2-メチルブタン、2,2-ジメチルプロパンはいずれも C5H12 で表せるので、これらの分子量は同じです。しかしその沸点は、ペンタン(36℃) > 2-メチルブタン(28℃) > 2,2-ジメチルプロパン(9.5℃)となっています。
この原因もやはり、分子間に働くファンデルワールス力の大小の差です。ペンタンは直鎖のアルカンなので、その表面積が大きく、周りの分子とのより強い引力で結びつきます。
一方、2-メチルブタンは側鎖を持つため、分子の構造が空間的にやや丸まっています。そうなると周囲の分子と接する表面積が減り、分子間力は弱まります。さらに枝分かれの多い2,2-ジメチルプロパンだと、より立体的に球状に近づくため、分子間力はもっと弱まります。
よって、アルカンの沸点は直鎖のほうが高く、枝分かれが増えるほどに低くなる傾向があります。
融点
融点も基本的には沸点と同様に、炭素数が増えるほどファンデルワールス力が強く働き融点が高くなります。
しかし、炭素数1~3は例外で、融点が下がります(というよりも、ほとんど横並びです)。とはいえ、炭素数1~3はかなり特殊な状況でない限りは気体ですので、融点を気にする必要はありません。そういう意味では、炭素数4~の特徴を理解しておけば十分です。
同じ炭素数の異性体については、その結晶状態の充填密度によって融点の大小が決まります。しかし、枝分かれが多ければ充填密度が高い場合もあれば低い場合もあり、構造からだけでは判断ができません。
そのため、アルカンの異性体の融点を比較する機会はあまりないかと思われます。もちろん、融点は経験的に定まっているので、調べることは可能です。
溶解度・密度
有機化合物には水に溶けないものが多くありますが、アルカンもその一例です。アルカンは無極性分子なので疎水性となります。逆に、ベンゼンのような有機溶媒には溶けやすいです。
密度は1よりも軽いため、水に浮きます。アルカンの中で比べると、分子量が増えるほど密度も上がる傾向にありますが、やはり水に浮くこと(=密度が1未満)に違いはありません。
構造異性体
炭素数4以上のアルカンには、主鎖の他に側鎖を含む場合があります。

上図の2つの化合物はともにC4H10で表すことができるため、これらは互いに異性体(構造異性体)です。
同様に炭素数5のアルカン(C5H12)の異性体について考えると、以下の3通りあります。
続いて炭素数6のアルカン(C6H14)を考えると、こちらは5つの異性体があります。
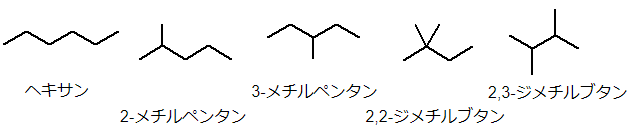
炭素数7のアルカン(C7H16)なら9つの異性体、炭素数8のアルカン(C8H18)なら18種、炭素数9のアルカン(C9H20)なら35種と、その数はどんどん増えていきます。

コメント
C5H12の構造異性体で2,2-メチルプロパンと記載されていますが、2,2-ジメチルプロパンが正解ではないでしょうか?
修正しました。
ご指摘ありがとうございます!