この項では、4種の重要な反応中間体を取り上げます。反応中間体とは、その名の通り反応の途中において一時的に生成される物質のことです。往々にして不安定な物質のため、基質が反応中間体になっても、最終的には安定した生成物へと変化します。
炭素原子を含む重要な中間体は主に4種ほどあり、それらは以下の通りです。
- カルボカチオン
- カルボアニオン(カルバニオン)
- カルボラジカル
- カルベン
カルボカチオン
カルボ(carbo-)はカーボン(carbon)、つまり炭素のことです。カチオンは陽イオンのことを指します。よって、カルボカチオンとは、「正に帯電した炭素」ということになります。また、炭素から出る結合は3本であり、sp2混成軌道を取ります。
カルボカチオンの炭素原子と結合する炭素の数によりカチオンの安定性が変わりますが、安定性の大小は以下の通りです。
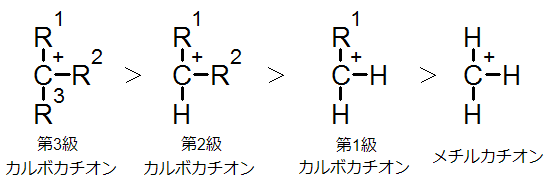
上の図で第3級カルボカチオンの安定性が高いのは誘起効果(I効果)によってカルボカチオンの正電荷が非局在化するためです。
誘起効果(I効果)とは、ある原子(原子団)が他の原子の静電的環境に影響を及ぼすことをいいます。
今回の例だと、正電荷の電気的偏りを抑えるために、隣にある炭素原子から電子(の一部)が供給されることになります。そうすると正電荷は弱まり、カルボカチオン全体で見ると電荷の偏りが少なくなります。
電子供与基となる炭素原子(アルキル基など)はこのように隣の正電荷に電子を分け与えることができますが、水素原子ではそのようなことができません。
そのため、メチルカチオンは誘起効果がなく電荷の偏りが大きいために不安定となります。それよりはアルキル基が1つ付いた第1級カルボカチオンのほうが安定で、さらに第2級、第3級カルボカチオンの順に安定度が増します。
カルボアニオン(カルバニオン)
カルボアニオンは負に帯電した炭素のことです。カルボカチオンは炭素に付く原子団が3つであったためsp2混成軌道を取っていましたが、カルボアニオンの炭素は3つの原子団との結合に加え孤立電子対を持つためその軌道はsp3混成軌道を取ることになります。
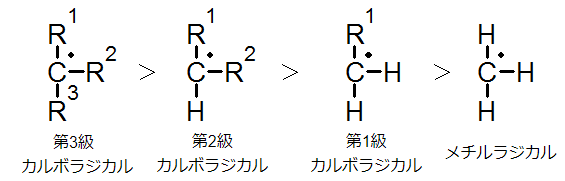
カルボアニオンの安定性の大小は以下のとおりです。

こちらはカルボカチオンの時とは逆になっています。しかし、ここでも電荷の偏りが小さいほうが安定である、という原則は同じです。
つまり、中心にある負電荷を周りに分散させたほうが安定になるのですが、隣にある原子が電子供与性基である炭素原子だとなかなか電子を受け取ってもらえません。一方、隣の原子が水素であれば、アニオンの負電荷をうまく流すことができるというわけです。
ちなみに、水素の代わりに、電気陰性度の高い電子求引性基であるハロゲンなどを用いれば、さらにスムーズに電子を非局在化できるので、より安定なアニオンとなります。
カルボラジカル
前の項で見たように、1つの不対電子を持った原子をラジカルといいます。つまり、カルボラジカルは不対電子を持つ炭素ということになります。
ラジカルの炭素は3つの結合を持ち、sp2混成軌道を取ります。ラジカルはカチオンやアニオンと比べても非常に反応性に富み(それだけ不安定だといえます)、一度ラジカル反応が開始されると非常に速い速度で連鎖反応が起こります。
ラジカルの相対的な安定性は、カチオンの時と同様の順序です。これは、ラジカルの炭素が8電子則から考えて電子不足であるので、カチオンの時と同じ考え方に基づきます。
カルベン
価電子が6で、かつ電荷を持たない炭素をカルベンといいます。
最も単純なカルベンは以下の構造を持つメチレンです。
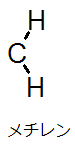
本来は最外殻電子数が8つであることが望ましいのでカルベンは残り2つ分の電子を受け入れるような反応が起こりやすいです。言い換えると、求電子性が高いということになります。

コメント