基本的な有機反応といえば、置換反応・付加反応・脱離反応・転位反応の4つが挙げられます。この項ではこれらの反応の概説を説明します。具体的な反応についてはこれからの項でたびたび取り上げることになるので、ここでは概要説明だけにとどめます。
求電子試薬と求核試薬
有機反応は電子の移動が伴います。というよりも、電子の移動が反応そのものといえます。電子の豊富な化合物と電子の足りない化合物とが反応して安定な物質が出来る、といったイメージです。
電子が不足した試薬のことを求電子試薬といい、電子が過剰な試薬のことを求核試薬といいます。求電子・求核の考え方は重要ですので、各反応の説明に入る前にこれらについて記述します。
求電子試薬とは、その試薬自身が電子不足であり、電子密度の高い物質と反応するような試薬のことです。「電子」を「求」める「試薬」、とってもわかりやすい名前です。
自身が電子不足というのは、陽イオンや空軌道を持つ分子などが当てはまります。具体的には、H+、+NO2、BF3、FeBr3 などが挙げられます。
求核試薬は求電子試薬とは反対で、自身が電子過剰なため、電子密度の低い物質と反応します。電子過剰ということで、陰イオンや非共有電子対を持つ分子などが相当します。具体的には、–OH、CN–、ROH、NH3などです。
置換反応
置換反応とは、反応前の物質(これを基質といいます)の一部分が、反応試薬の一部分と置き換わる反応のことを指します。ここでいう「一部分」とは、原子であったり置換基であったりと様々です。
また、置換反応は「求電子置換反応」と「求核置換反応」に大別されます。基質に対して求電子試薬が反応すれば「求電子置換反応」で、求核試薬が反応すれば「求核置換反応」です。
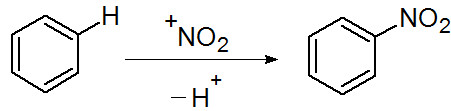
図1.求電子置換反応
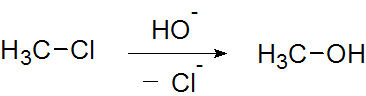
図2.求核置換反応
図1の反応では、基質であるベンゼンに対して求電子試薬であるニトロニウムイオンが反応し、ニトロベンゼンが生成されます(本来ならベンゼンに硝酸と硫酸を加える反応ですが、簡略化しています)。
図2の反応では、基質であるクロロメタンに対して求核試薬の水酸化物イオンが反応し、その結果メタノールが生成します。
付加反応
付加反応とは、不飽和結合(二重結合や三重結合)の1つの結合が切れ、そこに新たな原子や置換基が結合するような反応です。ここでも置換反応と同様、その反応試薬によって求電子付加反応と求核付加反応に大別されます。
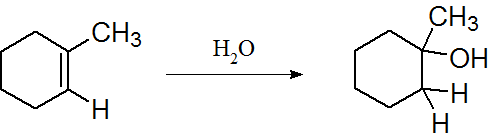
図3.求電子付加反応
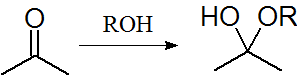
図4.求核付加反応
脱離反応
脱離反応は付加反応の反対と考えてください。つまり、分子内から2つの原子(または原子団)が抜けて、そこに結合が形成されるような反応です。結果として、二重結合(正確には多重結合)が生成します。
脱離反応の分類として、E1脱離(一分子脱離)とE2脱離(二分子脱離)がありますが、ここはひとつの大きなテーマになりますので、別の項で扱います。
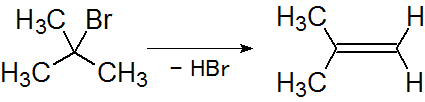
図5.脱離反応
転位反応
転位反応は原子や置換基が別のその分子の別の部位に移動するような反応です。水素が移動する水素移動が頻出です。アルキル移動やBaeyer-Villiger酸化(詳細は別の項で)などもあります。
これらの反応は、転位前の化合物よりも転位後の化合物のほうが安定であるために起こるものです。

図6.転位反応(水素移動)

コメント