問 題
MX2 の化学組成で表される化合物の代表的な構造に、蛍石 (CaF2) 型とルチル (TiO2) 型がある。これらの構造に関する次の記述の ㋐ ~ ㋓ に当てはまるものの組合せとして最も妥当なのはどれか。
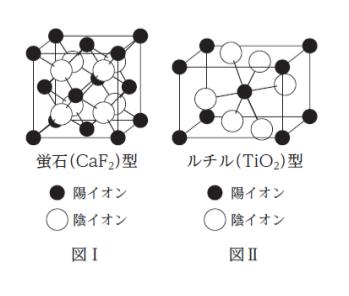
「蛍石型の構造では、図Ⅰのように、陽イオンが面心立方格子を、陰イオンが単純立方格子をつくっている。陰イオンには 4 個の陽イオンが正四面体形に配位している。すなわち、陰イオンの配位数は 4 であり、また、陽イオンの配位数は ㋐ である。
ルチル型の構造では、図Ⅱのように、陽イオンが体心正方格子をつくり、陽イオンには、陰イオンが正八面体形に配位している。よって、陽イオンの配位数は ㋑ である。
イオンの配列を剛体球モデルに基づいて考える。陽イオンは陰イオンがつくる隙間に入ると考えられるが、陽イオンの半径が陰イオンに比べて小さ過ぎると、陰イオンどうしが接してしまい不安定となる。陽イオンが、周りの陰イオンと接触して入り得る限界のイオン半径の比(陽イオン/陰イオン)は ㋒ の方が大きい。これらのことから、陰イオンの半径に対して陽イオンの半径が比較的大きいときには、 ㋒ の構造を、小さくなると ㋓ の構造をとりやすいと予想される。」
解 説
㋐ ですが
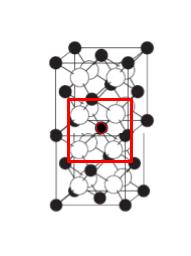
例えば CaF2 型の単位格子を 2 個縦に並べて考えると、陽イオンの配位数は 8 です。正解は 3 ~ 5 です。
㋑ ですが
正八面体の頂点は 6 なので、㋑ は 6 です。正解は 3 or 4 です。
㋒ ですが
陽イオンの半径が陰イオンの半径と比較して大きい方が、陰イオン同士が離れるので、より多く配位できます。つまり、配位数が多い結晶構造は、限界イオン半径比が大きくなると考えられます。
これはやや広い部屋の中央に、小さなコタツを置いて猫がどばーっと入ってくると数匹でぶつかるイメージと、相当広いコタツを置いて猫がどばーっと入ってくるとかなりたくさんぶつからずに色んな所から入れるイメージで納得しやすいのではないかと思われます。コタツの大きさが陽イオンの半径を、集まってくる猫が陰イオンのイメージです。
㋐、㋑ より、陽イオンの配位数が多いのが蛍石型なので、㋒ は蛍石型と考えられます。
以上より、正解は 3 です。
類題 H28no28 金属塩化物の結晶
https://yaku-tik.com/yakugaku/km-28-28/

コメント