問 題
反応速度に関する記述 ㋐、㋑、㋒のうち妥当なもののみを全て挙げているのはどれか。
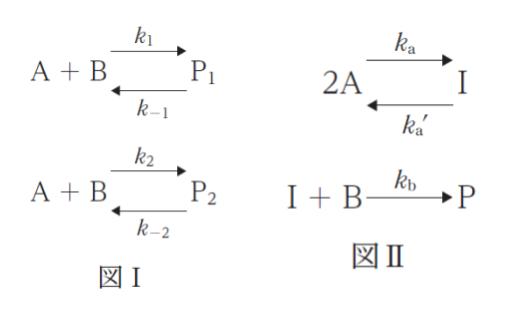
㋐ 図Ⅰのように、化合物 A、B には生成物 P1、P2 を生じる反応が起こり、これら二つの反応が拮抗している。これらの反応が平衡に達したときの P1 と P2 の濃度比 [P1]/[P2] は k-1/k1 ・k2/k-2 で与えられる。
㋑ 多段階反応では、通常、活性化エネルギーが最大のものが律速段階となるが、律速段階は反応に必要な物質の濃度が低いときにも発生し、活性化エネルギーのみで律速段階が定まらない場合もある。
㋒ 図Ⅱのように、2A+ B → P の反応が、中間体Ⅰを経由するもので、ka’ >> kb かつ B の濃度が十分に小さいとき、Pの生成速度は [A]2[B] に比例する。
1.㋐
2.㋐、㋑
3.㋐、㋒
4.㋑
5.㋑、㋒
解 説
㋐ ですが
図Ⅰ の上の式における平衡定数を K上 とおきます。K上 = [P1]/[A][B] です。
反応速度に注目します。
d[P1]/dt = k1[A][B]-k-1[P1] と表すことができます。平衡状態の時、左辺 0 なので
k-1[P1] = k1[A][B] より、平衡定数 K上 = k1/k-1 です。
同様に、図Ⅰの下の式における平衡定数を K下 とおけば、K下 = [P2]/[A][B] = k2/k-2 です。
[P1]/[P2] = K上/K下 = (k1/k-1)/(k2/k-2) = k1k-2/k-1k2 です。㋐ の式は、分母分子が逆です。よって、㋐ は誤りです。
㋑ は妥当な記述です。
㋒ も妥当です。
d[P]/dt = kb[I][B] です。また、定常状態近似を用いて、[I] に注目すれば、0 = d[I]/dt = ka[A]2 -ka'[I] -kb[I][B] です。[I] について解けば

d[P]/dt = kb[I][B] → a'[A]2[B] (※a’ = kb × a )となり、たしかに P の生成速度は [A]2[B] に比例します。
以上より、正解は 5 です。

コメント