化学量論は
化学反応における量的関係に関する理論です。化学量論は一般には経験則である定比例の法則、倍数比例(倍数組成)の法則として知られています。
定比例の法則とは
物質が化学反応する時、反応に関与する物質の質量の割合は、常に一定であるという法則です。例えば、銅と酸素が反応して酸化銅が生じる時、質量比が 4 : 1 で反応するといった例があげられます。
倍数比例(倍数組成)の法則とは
同じ成分元素からなる化合物の間に成り立つ法則です。例えば C と O からなる CO と CO2 の間について、同じ質量の C を含む場合に、O の質量比が簡単な整数比を示すという法則です。原子的な存在を強く示唆する法則といえます。
定比例や倍数比例は、化学反応式で表される反応を知識としていきなり学んでしまう現代の学生には当たり前に感じてしまうと思います。しかし、そのような表現がなく、原子という概念もない時代において、自然の奥深くに眠る、単純で神秘的性質が垣間見える発見・法則に感じたと推測されます。
代表的な化学変化として『水素 H2 と 酸素 O2 から、水 H2O ができる』という化学変化を例にあげ、化学反応式について説明します。化学反応式の書き方は、反応前の物質を左側、反応後の物質を右側に書き矢印で結びます。原子の種類、数が変わらないように係数を決めれば OK です。
H2 + O2 → H2O とすると、H の数は良いのですが、O の数があいません。そこで O2 の係数を 1/2 とすれば OK です。
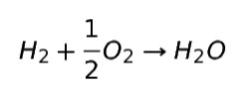
水素 1 mol と 酸素 1/2 mol が反応して、水 1 mol ができる ということを表現しています。
その後測定技術が発達すると、化学物質の変化量が反応前、反応後だけでなく、リアルタイムで測定できるようになります。すると反応の進行速度などについて、反応速度式として定式化され、物質量やモル濃度そして温度が化学反応の成分量やその変化量に強く影響を及ぼすことが明らかとなります。化学反応の量的関係についての『化学量論』と対比し、化学反応の速度については『反応速度論』と呼ばれます。物理化学などで学ぶ分野です。

コメント